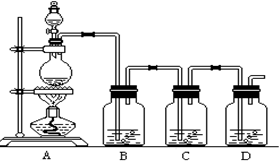
题目内容
19.(1)请写出实验室制氯气的离子方程式:离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O
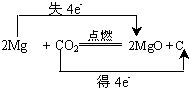
(2)写出镁与二氧化碳反应的方程式并用双线桥标出电子转移方向和数目:
化学方程式:
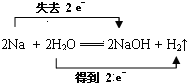
(3)写出钠与水反应的化学方程式并用双线桥标出电子转移方向和数目:
化学方程式:
 .
.
分析 (1)二氧化锰与足量的浓盐酸反应生成氯化锰、氯气和水;
(2)镁条与二氧化碳反应会生成碳与氧化镁,结合方程式2Mg+CO2 $\frac{\underline{\;点燃\;}}{\;}$2MgO+C判断;
(3)Na与H2O反应生成氢氧化钠和氢气,反应中Na、H元素化合价发生变化.
解答 解:(1)二氧化锰与足量的浓盐酸反应生成氯化锰、氯气和水,离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)Mg与CO2反应的化学方程式为:2Mg+CO2 $\frac{\underline{\;点燃\;}}{\;}$2MgO+C,反应中镁失电子,碳得到电子生成碳单质,双线桥表示的氧化还原反应为: ,故答案为:
,故答案为: ;
;
(3)Na与H2O反应的化学方程式:2Na+2H2O=2NaOH+H2↑,钠元素化合价0价变化为+1价失电子做还原剂被氧化,氢元素化合价+1价变化为0价,H2O做氧化剂被还原,电子转移总数为2e-,在化学方程式上标注失电子和得到电子的转移总数,用“双线桥”标出反应中电子转移的方向和数目为: ,
,
故答案为: .
.
点评 本题考查氧化还原反应,为高考高频考点,侧重于学生的分析能力的考查,注意元素化合价的判断以及氧化还原反应中电子转移,为解答该题的关键,把握用双线桥法标出电子转移方向和数目的方法,难度中等.

练习册系列答案
相关题目
9.短周期元素X、Y、Z、W、Q在周期表中的相对位置如图所示.下列说法不正确的是( )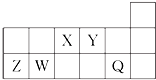

| A. | X与Y可以形成5种以上的化合物 | |
| B. | Y分别与Z、W形成的化合物的晶体类型相同 | |
| C. | 工业上常用电解法生产Z、Q的单质 | |
| D. | 简单气态氢化物的热稳定性:Y>X>W |
10.下列9种物质,Al、SO2、Al2O3、Al(OH)3、Mg(OH)2、NaHSO4、NaHCO3、(NH4)2CO3、NH4Cl既能与强酸溶液反应又有与强碱溶液反应的物质有( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
14.下列装置或操作能达到实验目的是( )


| A. | 用装置甲制取氯气 | |
| B. | 用装置乙除去氯气中的少量氯化氢 | |
| C. | 用装置丙分离二氧化锰和氯化锰溶液 | |
| D. | 用装置丁将饱和食盐水完全蒸干制NaCl |
4.以铁为阳极,以铜为阴极,对足量的NaOH溶液进行电解.一段时间后得到1molFe(OH)3沉淀,此间共消耗的水的物质的量为( )
| A. | 2mol | B. | 2.5 mol | C. | 3.5mol | D. | 5mol |
8.NA表示阿伏加德罗常数,则下列说法正确的是( )
| A. | 2.4g Mg变成Mg2+时失去的电子数为0.1 NA | |
| B. | 标准状况下,11.2 L水所含的原子数为1.5 NA | |
| C. | 在常温常压下,32g氧气所含原子数目为2NA | |
| D. | 0.1mol/LK2SO4溶液含有 K+0.2 NA |