题目内容
15.一定温度时,测得纯水中c(OH-)=2.5×10-7 mol•L-1,则c(H+)为( )| A. | 2.5×10-7 mol•L-1 | B. | 1.0×10-7 mol•L-1 | ||
| C. | $\frac{1×1{0}^{-14}}{2.5×1{0}^{-7}}$mol•L-1 | D. | 无法确定c(H+) |
分析 任何温度下,纯水中氢离子浓度等于氢氧根离子浓度,离子积为常数,但只有在常温下Kw=10-14,据此分析解答.
解答 解:纯水呈中性,所以纯水中氢原子浓度等于氢氧根离子浓度,为2.5×10-7 mol•L-1,
故选:A.
点评 本题考查了离子浓度的计算,明确纯水电离的特点是解本题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列变化中,属于化学变化的是( )
| A. | 氯水光照后褪色 | B. | 溴挥发 | ||
| C. | 碘升华 | D. | 溴水加CCl4后溴水层褪色 |
6.下列溶液中导电性最强的是( )
| A. | 1L 0.1mol/L醋酸 | B. | 0.5L 0.1mol/L H2SO4溶液 | ||
| C. | 1L 0.1mol/L盐酸 | D. | 2L 0.1mol/L H2SO3溶液 |
3.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 将100mL 0.1mol•L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数目为0.0l NA | |
| B. | Na2O2与足量的水反应生成1 molO2,转移电子数目为2 NA | |
| C. | 某密闭容器中有2mo1SO2和1mol O2,在一定条件下充分反应,转移的电子数为4 NA | |
| D. | 18g重水(D2O)所含的电子数为1 NA |
10.下列9种物质,Al、SO2、Al2O3、Al(OH)3、Mg(OH)2、NaHSO4、NaHCO3、(NH4)2CO3、NH4Cl既能与强酸溶液反应又有与强碱溶液反应的物质有( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
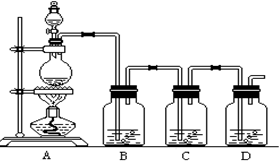
20.用下列实验装置完成对应实验,能达到实验目的是( )
| A. | 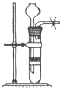 用大理石和盐酸制取CO2 | B. | 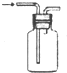 用排气法收集氨气 | ||
| C. | 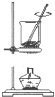 将干海带灼烧成灰 | D. | 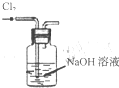 除去Cl2中的HCl |
4.以铁为阳极,以铜为阴极,对足量的NaOH溶液进行电解.一段时间后得到1molFe(OH)3沉淀,此间共消耗的水的物质的量为( )
| A. | 2mol | B. | 2.5 mol | C. | 3.5mol | D. | 5mol |
5.如下表所示将a溶液逐滴加入装有b溶液的试管中,下列现象对应的离子方程式错误的是( )
| 选项 | a | b | 试管中现象 | 离子方程式 |
| A | 硫酸 | KI淀粉 | 在空气中放置一段时间后溶液呈蓝色 | 4H++4I-+O2═2I2+2H2O |
| B | 稀盐酸 | Na2CO3 | 开始时无气泡,后来有气泡 | CO32-+H+═HCO3-; HCO3-+H+═H2O+CO2↑ |
| C | 稀盐酸 | Na2SiO3 | 产生白色胶状物 | 2H++SiO32-═H2SiO3(胶体) |
| D | 硫酸 | 滴有酚酞的Ba(OH)2 | 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| A. | A | B. | B | C. | C | D. | D |