题目内容
下列各原子的电子排布式正确的是( )
| A、Fe[Ar]3d54s3 |
| B、F-1s22s22p5 |
| C、k[Ar]3d1 |
| D、p 1s22s22p63s23p3 |
考点:原子核外电子排布
专题:原子组成与结构专题
分析:A、根据泡利不相容原理,s轨道只能容纳2个电子判断;
B、F-核外有10个电子,据此判断;
C、根据能量最低原理判断;
D、根据原子核外电子排布规律判断;
B、F-核外有10个电子,据此判断;
C、根据能量最低原理判断;
D、根据原子核外电子排布规律判断;
解答:
解:A、根据泡利不相容原理,s轨道只能容纳2个电子,故A错误;
B、F-核外有10个电子,所以F-的核外电子排布应为1s22s22p6,故B错误;
C、4s轨道的能量要低于3d轨道,根据能量最低原理,电子应先排布在4s轨道上,故C错误;
D、根据原子核外电子排布规律,D正确;
故选D.
B、F-核外有10个电子,所以F-的核外电子排布应为1s22s22p6,故B错误;
C、4s轨道的能量要低于3d轨道,根据能量最低原理,电子应先排布在4s轨道上,故C错误;
D、根据原子核外电子排布规律,D正确;
故选D.
点评:本题主要考查了原子核外电子排布的几个规律,难度不大,解题时要细心.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列分子或离子中中心原子为用来成键的电子对最多的是( )
| A、NH4+ |
| B、NH3 |
| C、H2O |
| D、BCl3 |
中学常见物质A、B、C、D存在如图转化关系(部分生成物和反应条件略去).该转化关系中A可能是下列物质中的( )A
B
C
①金属钠 ②硫单质 ③NH3 ④Na2CO3 ⑤AlCl3溶液 ⑥单质铁.
| D |
| D |
①金属钠 ②硫单质 ③NH3 ④Na2CO3 ⑤AlCl3溶液 ⑥单质铁.
| A、3 | B、4 | C、5 | D、6 |
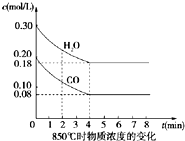 在一体积为10L密闭的容器中,通入一定量的CO和H2O(g),在850℃时发生以下反应:
在一体积为10L密闭的容器中,通入一定量的CO和H2O(g),在850℃时发生以下反应: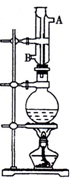 实验室利用如图中装置制取乙酸异戊酯,其合成过程为:
实验室利用如图中装置制取乙酸异戊酯,其合成过程为: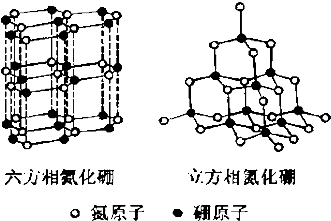 氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.
氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.