题目内容
2.下列物质能使品红溶液褪色,且褪色原理基本相同的是( )①活性炭
②新制氯水
③二氧化硫
④臭氧
⑤过氧化钠
⑥双氧水.
| A. | ①②④ | B. | ②③⑤ | C. | ②④⑤⑥ | D. | ③④⑥ |
分析 能使品红溶液褪色,物质具有漂白性,具有漂白性的物质分为3类:强氧化性物质、二氧化硫、活性炭,以此解答.
解答 解:①活性炭具有吸附性,可使品红褪色;②④⑤⑥都具有强氧化性和漂白性,且漂白后的产物不能恢复到原来的颜色,具有不可逆性;③二氧化硫可与品红发生化合反应生成不稳定的无色物质,加热可恢复到原来的颜色,则褪色原理基本相同的是②④⑤⑥.
故选C.
点评 本题综合考查物质的性质,侧重于物质的漂白性的考查,注意把握漂白原理的对比,难度不大,注意相关基础知识的积累.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
13.下列各组中的两个反应所属反应类型相同的是( )
| A. | 光照甲烷和氯气的混合气体,混合气体颜色变浅;乙烯能使溴水褪色 | |
| B. | 乙烷在氧气中燃烧;乙烯在氧气中燃烧 | |
| C. | 乙烯能使溴水褪色;乙烯能使酸性高锰酸钾溶液褪色 | |
| D. | 工业上由乙烯和水反应生成乙醇;乙烯能使酸性高锰酸钾溶液褪色 |
10.下列药品的保存方法错误的是( )
| A. | 盛放NaOH溶液的试剂瓶用磨口玻璃塞 | |
| B. | 氢氟酸保存在塑料瓶中 | |
| C. | 过氧化钠保存在广口瓶中 | |
| D. | 浓盐酸保存在细口试剂瓶中 |
14.不饱和内酯是各种杀菌剂、杀虫剂、高分子改性剂、医药品的原料或中间体,合成不饱和内酯已引起人们极大的兴趣.以下是利用CO2合成一种不饱和内酯的反应方程式:2Me-C≡C-Me+CO2$\stackrel{适当条件}{→}$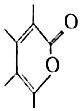 以下说法正确的是( )
以下说法正确的是( )
 以下说法正确的是( )
以下说法正确的是( )| A. | 一Me基团的电子式为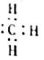 | |
| B. | 该合成过程的反应类型属于加成反应 | |
| C. | 产物与 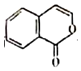 互为同分异构体 互为同分异构体 | |
| D. | 产物可与H2发生加成反应,反应的物质的量之比为1:3 |
11.钨主要用于制造硬质或耐高温的合金.自然界中黑钨矿的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、P、As的化合物.黑钨矿冶炼钨的工艺流程如图1:
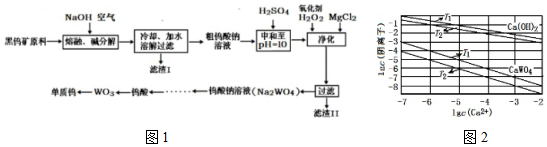
已知:①滤渣I的主要成份是Fe2O3、MnO2;
②上述流程中,除最后一步外,其余步骤中钨的化合价未变;
③常温下钨酸难溶于水.
回答下列问题:
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为+6,请写出MnWO4在熔融条件下发生碱分解反应生成MnO2的化学方程式2MnWO4+O2+4NaOH$\frac{\underline{\;高温\;}}{\;}$2MnO2+2Na2WO4+2H2O.
(2)上述流程中向粗钨酸钠溶液中加硫酸调pH=10后,溶液中的杂质阴离子为SiO32-、HAsO32-、HAsO42-、HPO42-等,“净化”过程中,加入H2O2的目的是氧化HAsO32-生成HAsO42-,滤渣Ⅱ的主要成分是MgSiO3、MgHAsO4、MgHPO4 .
(3)高温下密闭容器中用H2还原WO3可得到金属钨,其反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表.
已知:温度过高时,WO2(s)可转变为WO2(g).
WO2(s)+2H2(g)?W(s)+2H2O(g)△H=+66.0KJ•mol-1
WO2(s)?WO2(g)△H=+203.9KJ•mol-1
则在700℃时,WO2(g)与H2(g)反应生成固体W(s)的热化学方程式为WO2(g)+2H2(g)?W(s)+2H2O(g△H=-137.9kJ•mol-1.
(4)已知氢氧化钙和钨酸钙(CaWO4)都是微溶性的电解质,两者的溶解度均随温度升高而减小.不同温度下两种物质的沉淀溶解平衡曲线如图2,则T1时Ksp(CaWO4)=1×10-10.在钨酸钠溶液中加入石灰乳得到大量钨酸钙,则T2时该反应的平衡常数为1×103.
(5)利用电解法可以从碳化钨(WC)废料中回收钨.电解时,用碳化钨做阳极,不锈钢做阴极,盐酸为电解液,阳极析出钨酸并放出CO2,该阳极反应式为WC+6H2O-10e-=H2WO4+CO2↑+10H+.

已知:①滤渣I的主要成份是Fe2O3、MnO2;
②上述流程中,除最后一步外,其余步骤中钨的化合价未变;
③常温下钨酸难溶于水.
回答下列问题:
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为+6,请写出MnWO4在熔融条件下发生碱分解反应生成MnO2的化学方程式2MnWO4+O2+4NaOH$\frac{\underline{\;高温\;}}{\;}$2MnO2+2Na2WO4+2H2O.
(2)上述流程中向粗钨酸钠溶液中加硫酸调pH=10后,溶液中的杂质阴离子为SiO32-、HAsO32-、HAsO42-、HPO42-等,“净化”过程中,加入H2O2的目的是氧化HAsO32-生成HAsO42-,滤渣Ⅱ的主要成分是MgSiO3、MgHAsO4、MgHPO4 .
(3)高温下密闭容器中用H2还原WO3可得到金属钨,其反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表.
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成分 | WO3 W2O5 WO2 W |
WO2(s)+2H2(g)?W(s)+2H2O(g)△H=+66.0KJ•mol-1
WO2(s)?WO2(g)△H=+203.9KJ•mol-1
则在700℃时,WO2(g)与H2(g)反应生成固体W(s)的热化学方程式为WO2(g)+2H2(g)?W(s)+2H2O(g△H=-137.9kJ•mol-1.
(4)已知氢氧化钙和钨酸钙(CaWO4)都是微溶性的电解质,两者的溶解度均随温度升高而减小.不同温度下两种物质的沉淀溶解平衡曲线如图2,则T1时Ksp(CaWO4)=1×10-10.在钨酸钠溶液中加入石灰乳得到大量钨酸钙,则T2时该反应的平衡常数为1×103.
(5)利用电解法可以从碳化钨(WC)废料中回收钨.电解时,用碳化钨做阳极,不锈钢做阴极,盐酸为电解液,阳极析出钨酸并放出CO2,该阳极反应式为WC+6H2O-10e-=H2WO4+CO2↑+10H+.
1.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表: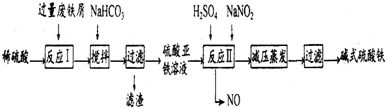
回答下列问题:
(1)反应I溶液中存在的金属阳离子有Fe2+、Al3+.
(2)加入NaHCO3的目的是调节pH,使溶液中的Al3+(填“Fe3+”、“Fe2+”或“A13+”)沉淀.该工艺流程中“搅拌”的作用是加快反应速率.
(3)反应II的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.在实际生产中,反应II常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作为氧化剂.若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2物质的量为2mol.
(4)碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成${[{F{e_2}{{({OH})}_4}}]^{2+}}$聚合离子.该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)反应I溶液中存在的金属阳离子有Fe2+、Al3+.
(2)加入NaHCO3的目的是调节pH,使溶液中的Al3+(填“Fe3+”、“Fe2+”或“A13+”)沉淀.该工艺流程中“搅拌”的作用是加快反应速率.
(3)反应II的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.在实际生产中,反应II常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作为氧化剂.若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2物质的量为2mol.
(4)碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成${[{F{e_2}{{({OH})}_4}}]^{2+}}$聚合离子.该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.