��Ŀ����
12��Ŀǰ��ҵ�ϳɰ���ԭ���ǣ�N2��g��+3H2��g��?2NH3��g����H=-93.0kJ/mol��1����֪һ�������£�2N2��g��+6H2O��l��?4NH3��g��+3O2��g����H=+1530.0kJ/mol��
���ʾ����ȼ���ȵ��Ȼ�ѧ����ʽΪH2��g��+$\frac{1}{2}$O2��g��=H2O��l����H=-286.0 kJ/mol��
��2���ں��º���װ���н��кϳɰ���Ӧ�������Ũ��-ʱ��ͼ�����£�
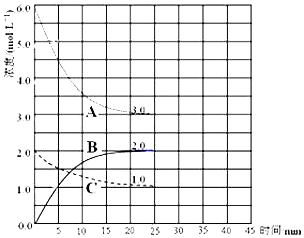
�ٱ�ʾN2Ũ�ȱ仯��������C������ţ���
��ǰ25min �ڣ���H2Ũ�ȱ仯��ʾ�Ļ�ѧ��Ӧ������0.12mol/��L•min����
����25minʱ����ȡ���д�ʩ����ʹN2��ת������ߵ���bdef������ţ���
a��ͨ��1molN2 b��ͨ��1molH2 c��ͨ��1molHe��
d��ͨ��1molNH3 e��ͨ��1molHCl f��ͨ��1molN2��3molH2
��3���ں��º�ѹװ���н��й�ҵ�ϳɰ���Ӧ������˵����ȷ����d������ţ���
a������������ٱ仯������ƽ��
b�������ܶȲ��ٱ仯������ƽ��
c��ƽ���ѹ�������������ɸ���NH3
d��ƽ�����װ����ͨ��һ����Ar��ƽ�ⲻ�ƶ�
��4���糧�����ѵ�������ӦΪ����4NH3��g��+6NO��g��?5N2��g��+6H2O��g����H��0
����ӦΪ����2NH3��g��+8NO��g��?5N2O��g��+3H2O��g����H��0
ƽ��������N2��N2O�������¶ȵĹ�ϵ��ͼ��ʾ��

��ش���400��600Kʱ��ƽ��������N2�������¶ȵı仯���������¶����ߣ�N2�ĺ������ͣ��������ֹ��ɵ�ԭ��������ӦΪ���ȷ�Ӧ������ʹ����Ӧ��ƽ�����ƻ��߸���ӦΪ���ȷ�Ӧ������ʹ����Ӧ��ƽ�����ƣ�������NH3��NOŨ�ȣ�ʹ����Ӧ��ƽ�����ƣ�
���� ��1����֪��2N2��g��+6H2O��l��?4NH3��g��+3O2��g����H=+1530.0kJ/mol��
��N2��g��+3H2��g��?2NH3��g����H=-93.0kJ/mol�����ø�˹���ɽ�$\frac{�ڡ�2-��}{6}$�ɵ�����ȼ�յ��Ȼ�ѧ����ʽ��
��2���ٸ���ͼ���֪����Ӧ���е�25minʱ����A������6mol/L-3mol/L=3mol/L��C������2.0mol/L-1.0mol/L=1.0mol/L����˸��ݷ���ʽ��֪��ʾN2Ũ�ȱ仯��������C��H2Ũ�ȱ仯������ΪA��BΪ������Ũ�ȱ仯���ߣ�
����ͼ��֪��ƽ��ʱ��c��A��=3mol/L����c��B��=2mol/L����c��C��=1mol/L���ʡ�c��A������c��B������c��C��=3��2��1����A����������B����������C��������������v=$\frac{��c}{��t}$����v��H2����
�����N2��ת���ʣ�Ӧʹƽ�������ƶ���������ѹǿ������������Ũ�ȵȣ�
��3��a������Ӧ��������ٵĿ��淴Ӧ������ں��º�ѹ������������ٱ仯ʱ��ƽ�⣻
b���ڷ�Ӧ����������ʼ�ղ��䣬�������ݻ��DZ仯�ģ������ܶ��DZ仯�ģ���������ܶȲ��ٱ仯˵����Ӧ�ﵽƽ�⣻
c��ƽ�����װ����ͨ��һ����Ar��ѹǿ���䣬�����ݻ����ӣ�Ũ�Ƚ��ͣ�ƽ�����淴Ӧ�����ƶ���
d��ƽ���ѹ��������ѹǿ����ƽ��������Ӧ������У�
��4������ͼ2�������¶����ߣ�������N2O�ĺ����仯���з����������¶ȶԻ�ѧƽ��Ӱ�켰�������淴Ӧ�ķ�Ӧ��������з�����
��� �⣺��1����֪��2N2��g��+6H2O��l��?4NH3��g��+3O2��g����H=+1530.0kJ/mol��
��N2��g��+3H2��g��?2NH3��g����H=-93.0kJ/mol�����ø�˹���ɽ�$\frac{�ڡ�2-��}{6}$�ɵ�H2��g��+$\frac{1}{2}$O2��g��=H2O��l����H=-286.0 kJ/mol��
�ʴ�Ϊ��H2��g��+$\frac{1}{2}$O2��g��=H2O��l����H=-286.0 kJ/mol��
��2���ٸ���ͼ���֪����Ӧ���е�25minʱ����A������6mol/L-3mol/L=3mol/L��C������2.0mol/L-1.0mol/L=1.0mol/L����˸��ݷ���ʽ��֪��ʾN2Ũ�ȱ仯��������C��AŨ�ȱ仯������ΪH2��BΪ������Ũ�ȱ仯���ߣ�
�ʴ�Ϊ��C��
����ͼ��֪��ƽ��ʱ��c��A��=3mol/L����c��B��=2mol/L����c��C��=1mol/L���ʡ�c��A������c��B������c��C��=3��2��1����A����������B����������C������������v��H2��=$\frac{3mol/L}{25min}$=0.12 mol•L-1•min-1���ʴ�Ϊ��0.12mol/��L•min����
��a��ͨ��1molN2����������ת���ʼ�С���ʴ���
b��ͨ��1molH2��ƽ�������ƶ���������ת���ʱ����ȷ��
c��ͨ��1molHe����ƽ�ⲻ�ƶ���������ת���ʲ��䣬�ʴ���
d��ͨ��1molNH3���൱������ѹǿ��ƽ�������ƶ���������ת���ʱ����ȷ��
e��ͨ��1molHCl������Ũ�ȼ�С��ƽ�������ƶ���������ת���ʱ����ȷ��
f��ͨ��1molN2��3molH2���൱������ѹǿ��ƽ�������ƶ���������ת���ʱ����ȷ��
��ѡ��bdef��
��3��a����ӦΪ���ȷ�Ӧ�������¶�ƽ��������У�����ת���ʼ�С����a����
b����������ı䷴Ӧ���ʲ��ı仯ѧƽ�⣬����ת���ʲ��䣬��b����
c��ͨ��1molHe����ѹ����ѹ����ƽ�ⲻ�䣬����ת���ʲ��䣬��c����
d��ͨ��1molHCl�Ͱ�����Ӧ���ٽ�ƽ��������У�����ת��������d��ȷ��
�ʴ�Ϊ��d��
��4������ͼ���֪����400K��600Kʱ��ƽ��������N2�������¶ȵ��������ͣ�����ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�����������ƶ��������ĺ�����С��
�ʴ�Ϊ�����¶����ߣ�N2�ĺ������ͣ�����ӦΪ���ȷ�Ӧ������ʹ����Ӧ��ƽ�����ƻ��߸���ӦΪ���ȷ�Ӧ������ʹ����Ӧ��ƽ�����ƣ�������NH3��NOŨ�ȣ�ʹ����Ӧ��ƽ�����ƣ�
���� ���⿼���˹���ɡ���ѧƽ��ͼ��ѧƽ���ƶ���Ӱ�����ء�ԭ���ԭ����Ӧ�ú͵缫��Ӧ��д����Ŀ�Ѷ��еȣ�ע��Ի���֪ʶ���������գ�

| A�� | ���������Ӽ���ʳ������彡�����к�������ʳ�� | |
| B�� | �����������Ѽ�·�ˡ����������γɵ����ܽ��ж����ЧӦ | |
| C�� | ����ȱ����Ԫ�أ����Բ��������������Ҷ������ | |
| D�� | ������һ�գ���ˮ�����գ���ȡ֭���������϶������ص���ȡ���ڻ�ѧ�仯 |
| A�� | 0.5 Ħ1��3-����ϩ�����к��й��ۼ���Ϊ5.5N0 | |
| B�� | 1 mol����-CH3�������ĵ�������Ϊ9N0 | |
| C�� | 1 mol-OH��1 mol OH-������������Ϊ9N0 | |
| D�� | 1 mol̼�����ӣ�CH3+�������ĵ�������Ϊ8N0 |
| A�� | $\frac{1000Va}{MV+1120}$ mol•L -1 | B�� | $\frac{1000Va}{MV+22400}$ mol•L -1 | ||
| C�� | $\frac{1000Va}{MV+11200}$ mol•L -1 | D�� | $\frac{1000V•M}{2240��V+0.5��a}$ mol•L -1 |
| A�� | �����£�4.2g��ϩ�ͱ�ϩ�Ļ�������к��еķǼ��Լ�����Ϊ0.6NA | |
| B�� | ��⾫��ͭʱ������·��ת��NA�����ӣ������ܽ�32 gͭ | |
| C�� | �ں���CH3COO-Ϊ1.0 mol•L-1�Ĵ�����Һ�У�H+��Ŀ�Դ���NA | |
| D�� | V L a mol•L-1���Ȼ�����Һ�У���Fe3+����ĿΪ NA����Cl-����Ŀ����3NA |
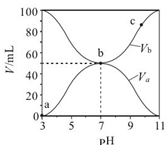
| A�� | Ka��HA��=10-6 mol•L-1 | |
| B�� | b ��ʱ��c��B+��=c��A-��=c��H+��=c��OH-�� | |
| C�� | c ��ʱ��$\frac{c��{A}^{-}��}{c��O{H}^{-}��•c��HA��}$���¶����߶���С | |
| D�� | a��c ������ˮ�ĵ���̶�ʼ������ |
�ٻ���̿��
��������ˮ��
�۶�������
�ܳ�����
�ݹ������ơ�
��˫��ˮ��
| A�� | �٢ڢ� | B�� | �ڢۢ� | C�� | �ڢܢݢ� | D�� | �ۢܢ� |