题目内容
15.NA为阿伏伽德罗常数的值.下列说法正确的是( )| A. | 44gCO2和N2O的混合物中含有的氧原子数为1.5NA | |
| B. | 2L0.5mol/L亚硫酸氢钠溶液中含有的HSO3-离子数为NA | |
| C. | 氢氧化钠与氯气反应时,生成0.1molNaCl转移的电子数为0.1NA | |
| D. | 一定条件下在密闭容器中2molSO2与2molO2充分反应,最终的气体分子数为3NA |
分析 A.CO2和N2O摩尔质量都是44g/mol,二氧化碳含有2个氧原子,N2O含有1个氧原子;
B.亚硫酸氢根离子为弱酸的酸式根离子,在水溶液中部分电离,部分发生水解;
C.氢氧化钠与氯气反应为歧化反应,生成1mol氯化钠转移1mol电子;
D.二氧化硫与氧气反应生成三氧化硫为可逆反应,可逆反应不能进行到底.
解答 解:A.二氧化碳含有2个氧原子,N2O含有1个氧原子,44gCO2和N2O的混合物,二氧化碳和一氧化二氮的物质的量未知,无法计算含有氧原子个数,故A错误;
B.亚硫酸氢根离子为弱酸的酸式根离子,在水溶液中部分电离,部分发生水解,所以2L0.5mol/L亚硫酸氢钠溶液中含有的HSO3-离子数小于NA,故B错误;
C.氢氧化钠与氯气反应为歧化反应,生成1mol氯化钠转移1mol电子,则生成0.1molNaCl转移的电子数为0.1NA,故C正确;
D.二氧化硫与氧气反应生成三氧化硫为可逆反应,可逆反应不能进行到底,所以一定条件下在密闭容器中2molSO2与2molO2充分反应,最终的气体分子数大于3NA,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的分析应用,侧重考查氧化还原反应转移电子数计算、微粒个数计算,解题时注意可逆反应不能进行到底的特点,题目难度不大.

练习册系列答案
相关题目
3.A、B、C、D都是短周期元素,原子半径:D>C>A>B.已知A、B处在同一周期,A、C处在同一主族,C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层上的电子数是D原子最外层电子数的3倍.下列说法中正确的是( )
| A. | 简单离子半径:D>B | |
| B. | 气态氢化物的稳定性:A>B | |
| C. | B、D两元素可组成阴、阳离子个数比为1:1的化合物 | |
| D. | B、C、D三种元素可组成化学式为DCB2的化合物,其水溶液显碱性 |
10.化学与生活密切相关.下列说法正确的是( )
| A. | 棉、蚕丝、合成纤维完全燃烧都只生成CO2和H2O | |
| B. | 牛奶、鸡蛋清均可用于重金属中毒解毒 | |
| C. | 白菜上洒少许福尔马林,既保鲜又消毒 | |
| D. | 氨水能导电,说明氨气是电解质 |
20.早在古代,我国人民就积累了不少对化学物质变化的认识.例如,晋代炼丹家、医学家葛洪所著《抱朴子》一书中记载有“丹砂烧之成水银,积变又成丹砂”.这句话中的丹砂指的是HgS,下列关于这句话的说法正确的是( )
| A. | 这个过程只涉及物理变化 | |
| B. | 这个过程是可逆反应 | |
| C. | 这个过程发生了复分解反应 | |
| D. | “丹砂烧之成水银”过程中还可能产生SO2 |
7.2015年8月12日,天津港大爆炸造成大量危险化学品NaCN(氰化钠)的部分泄露.泄露的NaCN可用双氧水处理,其化学反应方程式:NaCN+H2O2+H2O═NaHCO3+NH3,下列有关说法正确的是( )
| A. | 0.1 mol NaCN中含共价键数为0.3NA | |
| B. | 0.1 mol/L NaHCO3溶液HCO3-的数目小于0.1NA | |
| C. | 19 g H218O2含有的中子数为12NA | |
| D. | 上述反应中,当有2.24 L NH3生成时,转移电子数为0.2NA |
4.下列有关实验现象和解释或结论都正确的是( )
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2?Ν2O4的△H<0 |
| B | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡 | 下层分别呈无色和紫红色 | 还原性:I->Br->Fe2+ |
| C | 某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水 | 有白色沉淀出现 | 该钾盐是K2CO3 |
| D | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
 .
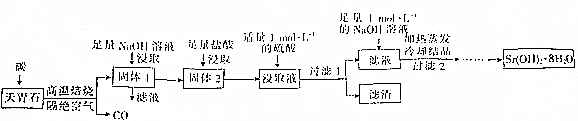
.
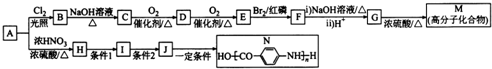
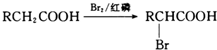
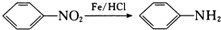 (-NH2易被氧化)
(-NH2易被氧化) 、
、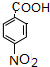 .
.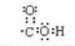 .H的化学名称为对硝基甲苯.
.H的化学名称为对硝基甲苯. $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$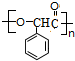 +nH2O.
+nH2O.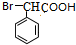 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$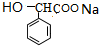 +NaBr+H2O.
+NaBr+H2O.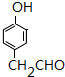 .
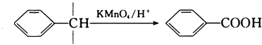
. 的合成路线CH3CH2CH2OH$→_{催化剂}^{氧气}$CH3CH2CHO$→_{催化剂}^{氧气}$CH3CH2COOH$\stackrel{溴/红磷}{→}$CH3CHBrCOOH$\stackrel{氢氧化钠醇溶液}{→}$CH2=CHCOOH$→_{△}^{甲醇/浓H_{2}SO_{4}}$CH2=CHCOOCH3$\stackrel{催化剂}{→}$
的合成路线CH3CH2CH2OH$→_{催化剂}^{氧气}$CH3CH2CHO$→_{催化剂}^{氧气}$CH3CH2COOH$\stackrel{溴/红磷}{→}$CH3CHBrCOOH$\stackrel{氢氧化钠醇溶液}{→}$CH2=CHCOOH$→_{△}^{甲醇/浓H_{2}SO_{4}}$CH2=CHCOOCH3$\stackrel{催化剂}{→}$