题目内容
5.以芳香烃A为原料,合成有机物M和N的路线如图所示(部分反应条件略去).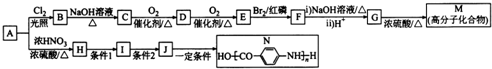
已知:
①A的蒸汽密度是同条件下H2密度的53倍
②
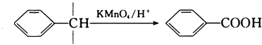
③
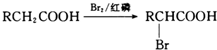
④
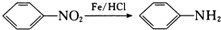 (-NH2易被氧化)
(-NH2易被氧化)回答下列同题:
(1)A、I的结构简式分别为
 、
、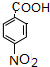 .
.(2)F中含氧官能团的电子式为
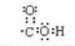 .H的化学名称为对硝基甲苯.
.H的化学名称为对硝基甲苯.(3)C→D、J→N的反应类型分别为氧化反应、缩聚反应.
(4)G→M的化学方程式为n
 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$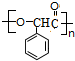 +nH2O.
+nH2O.加热条件下,F与足量NaOH溶液反应的化学方程式为
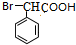 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$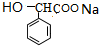 +NaBr+H2O.
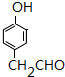
+NaBr+H2O.(5)E的同分异构体中,既能发生银镜反应又能与FeCl3溶液发生显色反应的有13种(不考虑立体异构);其中核磁共振氢谱有5种吸收峰,且峰面积之比为1:2:2:2:1的结构简式为
 .
.(6)结合题中信息和所学知识,设计一条以CH3CH2CH2OH和CH3OH为原料制备
 的合成路线CH3CH2CH2OH$→_{催化剂}^{氧气}$CH3CH2CHO$→_{催化剂}^{氧气}$CH3CH2COOH$\stackrel{溴/红磷}{→}$CH3CHBrCOOH$\stackrel{氢氧化钠醇溶液}{→}$CH2=CHCOOH$→_{△}^{甲醇/浓H_{2}SO_{4}}$CH2=CHCOOCH3$\stackrel{催化剂}{→}$
的合成路线CH3CH2CH2OH$→_{催化剂}^{氧气}$CH3CH2CHO$→_{催化剂}^{氧气}$CH3CH2COOH$\stackrel{溴/红磷}{→}$CH3CHBrCOOH$\stackrel{氢氧化钠醇溶液}{→}$CH2=CHCOOH$→_{△}^{甲醇/浓H_{2}SO_{4}}$CH2=CHCOOCH3$\stackrel{催化剂}{→}$ (无机试剂任选).
(无机试剂任选).合成路线示例:CH≡CH$→_{催化剂/△}^{H_{2}}$CH3-CH3$→_{光照}^{Cl_{2}}$CH3CH2Cl.
分析 芳香烃A的蒸汽密度是同条件下H2密度的53倍,所以其相对分子质量为106,令分子组成为CxHy,则$\frac{106}{12}$=8…10,由烷烃中C原子与H原子关系可知,该烃中C原子数目不能小于7,故该芳香烃A的分子式为C8H10,其结构简式为 ,根据各物质的转化关系,A与氯气在光照条件下发生取代反应生成B为
,根据各物质的转化关系,A与氯气在光照条件下发生取代反应生成B为 ,B与氢氧化钠溶液发生水解生成C为
,B与氢氧化钠溶液发生水解生成C为 ,C催化氧化生成D为
,C催化氧化生成D为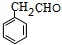 ,D氧化生成E为
,D氧化生成E为 ,E与溴发生信息③中的取代反应生成F为
,E与溴发生信息③中的取代反应生成F为 ,F发生水解生成G为
,F发生水解生成G为 ,G发生缩聚反应得M为
,G发生缩聚反应得M为 ,A与浓硫酸、浓硝酸发生硝化反应得H为
,A与浓硫酸、浓硝酸发生硝化反应得H为 ,H发生氧化反应生成I为
,H发生氧化反应生成I为 ,I发生还原反应生成J为
,I发生还原反应生成J为 ,J发生缩聚反应得N,以CH3CH2CH2OH和CH3OH为原料制备
,J发生缩聚反应得N,以CH3CH2CH2OH和CH3OH为原料制备 ,可以将CH3CH2CH2OH氧成CH3CH2COOH,再用CH3CH2COOH与溴发生取代反应生成CH3CHBrCOOH,CH3CHBrCOOH发生消去后与甲醇酯化再加聚可得产品,据此答题;
,可以将CH3CH2CH2OH氧成CH3CH2COOH,再用CH3CH2COOH与溴发生取代反应生成CH3CHBrCOOH,CH3CHBrCOOH发生消去后与甲醇酯化再加聚可得产品,据此答题;
解答 解:芳香烃A的蒸汽密度是同条件下H2密度的53倍,所以其相对分子质量为106,令分子组成为CxHy,则$\frac{106}{12}$=8…10,由烷烃中C原子与H原子关系可知,该烃中C原子数目不能小于7,故该芳香烃A的分子式为C8H10,其结构简式为 ,根据各物质的转化关系,A与氯气在光照条件下发生取代反应生成B为
,根据各物质的转化关系,A与氯气在光照条件下发生取代反应生成B为 ,B与氢氧化钠溶液发生水解生成C为
,B与氢氧化钠溶液发生水解生成C为 ,C催化氧化生成D为
,C催化氧化生成D为 ,D氧化生成E为
,D氧化生成E为 ,E与溴发生信息③中的取代反应生成F为
,E与溴发生信息③中的取代反应生成F为 ,F发生水解生成G为
,F发生水解生成G为 ,G发生缩聚反应得M为
,G发生缩聚反应得M为 ,A与浓硫酸、浓硝酸发生硝化反应得H为
,A与浓硫酸、浓硝酸发生硝化反应得H为 ,H发生氧化反应生成I为
,H发生氧化反应生成I为 ,I发生还原反应生成J为
,I发生还原反应生成J为 ,J发生缩聚反应得N,
,J发生缩聚反应得N,
(1)根据上面的分析可知,A为 ,I为
,I为 ,
,
故答案为: ;
; ;
;
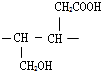
(2)F为 ,F中含氧官能团为羧基,其电子式为
,F中含氧官能团为羧基,其电子式为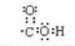 ,H为
,H为 ,H的化学名称为对硝基甲苯,
,H的化学名称为对硝基甲苯,
故答案为: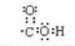 ;对硝基甲苯;
;对硝基甲苯;
(3)根据上面的分析可知,C→D的反应类型为氧化反应,J→N的反应类型为缩聚反应,
故答案为:氧化反应;缩聚反应;
(4)G→M的化学方程式为n $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +nH2O,
+nH2O,
F为 ,加热条件下,F与足量NaOH溶液反应的化学方程式为
,加热条件下,F与足量NaOH溶液反应的化学方程式为 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$ +NaBr+H2O,
+NaBr+H2O,
故答案为:n $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +nH2O;
+nH2O; +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$ +NaBr+H2O;
+NaBr+H2O;
(5)E为 ,E的同分异构体中,既能发生银镜反应又能与FeCl3溶液发生显色反应,说明有醛基和酚羟基,则符合条件的结构为苯环上连有-CH3、-OH、-CHO,有10种结构,或为苯环上连有-CH2CHO、-OH,有3种结构,所以共有13种,其中核磁共振氢谱有5种吸收峰,且峰面积之比为1:2:2:2:1的结构简式为
,E的同分异构体中,既能发生银镜反应又能与FeCl3溶液发生显色反应,说明有醛基和酚羟基,则符合条件的结构为苯环上连有-CH3、-OH、-CHO,有10种结构,或为苯环上连有-CH2CHO、-OH,有3种结构,所以共有13种,其中核磁共振氢谱有5种吸收峰,且峰面积之比为1:2:2:2:1的结构简式为  ,
,
故答案为:13; ;
;
(6)以CH3CH2CH2OH和CH3OH为原料制备 ,可以将CH3CH2CH2OH氧成CH3CH2COOH,再用CH3CH2COOH与溴发生取代反应生成CH3CHBrCOOH,CH3CHBrCOOH发生消去后与甲醇酯化再加聚可得产品,反应的合成路线为CH3CH2CH2OH$→_{催化剂}^{氧气}$CH3CH2CHO$→_{催化剂}^{氧气}$CH3CH2COOH$\stackrel{溴/红磷}{→}$CH3CHBrCOOH$\stackrel{氢氧化钠醇溶液}{→}$CH2=CHCOOH$→_{△}^{甲醇/浓H_{2}SO_{4}}$CH2=CHCOOCH3$\stackrel{催化剂}{→}$
,可以将CH3CH2CH2OH氧成CH3CH2COOH,再用CH3CH2COOH与溴发生取代反应生成CH3CHBrCOOH,CH3CHBrCOOH发生消去后与甲醇酯化再加聚可得产品,反应的合成路线为CH3CH2CH2OH$→_{催化剂}^{氧气}$CH3CH2CHO$→_{催化剂}^{氧气}$CH3CH2COOH$\stackrel{溴/红磷}{→}$CH3CHBrCOOH$\stackrel{氢氧化钠醇溶液}{→}$CH2=CHCOOH$→_{△}^{甲醇/浓H_{2}SO_{4}}$CH2=CHCOOCH3$\stackrel{催化剂}{→}$ ,
,
故答案为:CH3CH2CH2OH$→_{催化剂}^{氧气}$CH3CH2CHO$→_{催化剂}^{氧气}$CH3CH2COOH$\stackrel{溴/红磷}{→}$CH3CHBrCOOH$\stackrel{氢氧化钠醇溶液}{→}$CH2=CHCOOH$→_{△}^{甲醇/浓H_{2}SO_{4}}$CH2=CHCOOCH3$\stackrel{催化剂}{→}$ .
.
点评 本题考查有机物的推断与合成,难度中等,关键是利用A的相对分子质量推断A的结构,结合B的反应产物的C可以连续发生氧化反应判断B的结构,再根据反应条件及反应信息进行判断,是对有机物知识的综合考查,能较好的考查学生的分析思维能力,是有机热点题型.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 44gCO2和N2O的混合物中含有的氧原子数为1.5NA | |
| B. | 2L0.5mol/L亚硫酸氢钠溶液中含有的HSO3-离子数为NA | |
| C. | 氢氧化钠与氯气反应时,生成0.1molNaCl转移的电子数为0.1NA | |
| D. | 一定条件下在密闭容器中2molSO2与2molO2充分反应,最终的气体分子数为3NA |
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如表所示:
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(2)紫外光的光子所具有的能量约为399kJ•mol-1.根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.组成蛋白质的最简单的氨基酸中的碳原子杂化类型是sp2和sp3.
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
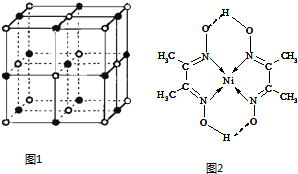
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有12个.
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.FeCl3和CuCl2中,适合作录音带磁粉原料的是FeCl3.
(5)某配合物的分子结构如图2所示,其分子内不含有AC(填序号).
A.离子键 B.极性键 C.金属键
D.配位键 E.氢键 F.非极性键.
| A. | 该溶液的pH一定等于1 | |
| B. | 阴离子肯定有I-,不能确定有无HCO${\;}_{3}^{-}$ | |
| C. | 阳离子肯定没有Fe3+,一定有Na+ | |
| D. | 该溶液含有的溶质成分可能为HI;或HI和NaI;或NaI和NaOH |
| 选项 | 现象或事实 | 解释 |
| A | 配制FeCl3溶液时,加入适量盐酸 | 增大Cl-浓度,可以抑制Fe3+水解 |
| B | Cl2通入人品红溶液中,品红褪色 | Cl2具有漂白性 |
| C | 久置的漂白粉质量减小 | 漂白粉中的Ca(ClO)2转化为CaCO3 |
| D | AgI可用于人工降雨 | AgI气化时吸热 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 钢化玻璃的成分与普通玻璃一样,有机玻璃是聚合物 | |
| B. | 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等 | |
| C. | 苹和甲苯互为同系物,均能使KMnCL4酸性溶液褪色 | |
| D. | 按系统命名法,化合物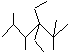 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 |
| A. | 过滤操作中,漏斗的尖端应接触烧杯内壁 | |
| B. | 从滴瓶中取用试剂时,滴管的尖嘴可以接触试管内壁 | |
| C. | 滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁 | |
| D. | 向容量瓶转移液体时,导流用玻璃棒可以接触容量瓶内壁 |

 ,F 到 G 的反应类型加成反应或还原反应
,F 到 G 的反应类型加成反应或还原反应 ,姜黄素的结构简式
,姜黄素的结构简式
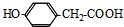 .
.
 ;
;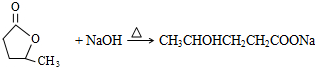 ;
;