题目内容
5.一些常见的单质、化合物有如图所示的转化关系(有些反应的条件和部分物质未全部列出).已知在常温常压下,F为红棕色气体;L为白色不溶于水的固体,它既能与盐酸反应又能与氢氧化钠反应;K为红褐色难溶物,A、H为生活中常见的两种金属;D为非金属气态单质.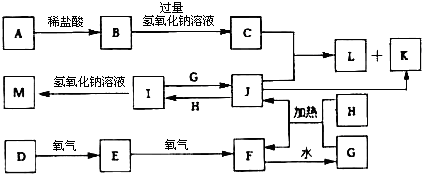
(1)B物质的化学式:AlCl3,D的名称:氮气.
(2)写出J+H→I的离子方程式2Fe3++Fe=3Fe2+.
(3)F→G的反应中,氧化剂与还原剂的物质的量之比为1:2,写出该反应的化学方程式3NO2+H2O=2HNO3+NO.
(4)铜与G的浓溶液反应过程中可能发生反应的离子方程式为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O、3Cu+8H++2NO3-=3Cu2++2NO2↑+4H2O.
(5)M放置在空气中颜色的变化为白色沉淀→灰绿色→红褐色沉淀,写出其发生变化的化学方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(6)H的最高价氧化物可与A发生反应,其反应方程式为Fe2O3+2Al $\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 .
(7)写出检验I溶液中阳离子的实验方法取少量I溶液于一支试管中,加入少量铁氰化钾溶液,若出现蓝色沉淀,证明有Fe2+(或取少量待测液于试管中,先加入KSCN溶液无现象,再加入氯水,溶液变为血红色,则证明有Fe2+).B、C、L均是含有同一元素的化合物,用离子方程式写出以B为主要原料制备L的可行方法Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
分析 常温常压下,F为红棕色气体,为NO2,非金属气态单质D与氧气反应得到E、E与氧气反应得到F,可推知D为N2,E为NO,F与水反应生成G为HNO3,金属H与硝酸反应生成J,J与H反应生成I,而I能与硝酸反应生成G,则H为变价金属,故H为Fe,J为Fe(NO3)3,I为Fe(NO3)2,M为Fe(OH)2.L为白色不溶于水的固体,它既能与盐酸反应又能与氢氧化钠反应,L为两性物质,含有Al元素,由转化关系可知金属A为Al,则B为AlCl3,C为NaAlO2,偏铝酸钠与硝酸铁发生双水解反应得到L与K,故L为Al(OH)3,K为Fe(OH)3,据此解答.
解答 解:常温常压下,F为红棕色气体,为NO2,非金属气态单质D与氧气反应得到E、E与氧气反应得到F,可推知D为N2,E为NO,F与水反应生成G为HNO3,金属H与硝酸反应生成J,J与H反应生成I,而I能与硝酸反应生成G,则H为变价金属,故H为Fe,J为Fe(NO3)3,I为Fe(NO3)2,M为Fe(OH)2.L为白色不溶于水的固体,它既能与盐酸反应又能与氢氧化钠反应,L为两性物质,含有Al元素,由转化关系可知金属A为Al,则B为AlCl3,C为NaAlO2,偏铝酸钠与硝酸铁发生双水解反应得到L与K,故L为Al(OH)3,K为Fe(OH)3.
(1)B物质的化学式:AlCl3,D的名称为氮气,故答案为:AlCl3;氮气;
(2)J+H→I的离子方程式:2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+;
(3)F→G的反应3NO2+H2O=2HNO3+NO,氧化剂、还原剂均为二氧化氮,由产物可知,氧化剂与还原剂的物质的量之比为1:2,1:2
故答案为:;3NO2+H2O=2HNO3+NO;
(4)铜与硝酸的浓溶液反应过程中可能发生反应的离子方程式为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O、3Cu+8H++2NO3-=3Cu2++2NO2↑+4H2O,
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O、3Cu+8H++2NO3-=3Cu2++2NO2↑+4H2O;
(5)Fe(OH)2放置在空气中颜色的变化为:白色沉淀→灰绿色→红褐色沉淀,发生变化的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:白色沉淀→灰绿色→红褐色沉淀;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(6)H的最高价氧化物为氧化铁,可与Al发生置换反应,其反应方程式为:Fe2O3+2Al $\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 ,
故答案为:Fe2O3+2Al $\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 ;
(7)检验Fe(NO3)2溶液中阳离子的实验方法:取少量I溶液于一支试管中,加入少量铁氰化钾溶液,若出现蓝色沉淀,证明有Fe2+(或取少量待测液于试管中,先加入KSCN溶液无现象,再加入氯水,溶液变为血红色,则证明有Fe2+);
用离子方程式写出以AlCl3,为主要原料制备Al(OH)3,的可行方法:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:取少量I溶液于一支试管中,加入少量铁氰化钾溶液,若出现蓝色沉淀,证明有Fe2+(或取少量待测液于试管中,先加入KSCN溶液无现象,再加入氯水,溶液变为血红色,则证明有Fe2+);Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
点评 本题考查无机物推断,涉及Al、Fe、N元素单质化合物的性质与转化,F物质的颜色、L的性质为推断突破口,难度中等,注意亚铁离子的检验方法.

 阅读快车系列答案
阅读快车系列答案
| A. | 电解前CuSO4溶液的物质的量浓度为2 mol/L | |
| B. | 电解后所得溶液中c(H+)=2 mol/L | |
| C. | 当n(e-)=0.6 mol时,V(H2):V(O2)=3:2 | |
| D. | 向电解后的溶液中先后加入16 g CuO和3.6g水,则溶液可恢复为电解前的浓度 |

| A. | 若将乙池电解液换成 AgNO3 溶液,则可以实现在石墨棒上镀银 | |
| B. | 甲池通入 CH3OH 的电极反应式为 CH3OH+6e-+2H2O═CO32-+8H+ | |
| C. | 反应一段时间后,向乙池中加入一定量 Cu(OH)2 固体,能使 CuSO4溶液恢复到 原浓度 | |
| D. | 甲池中消耗 224mL(标准状况下)O2,此时丙池中理论上产生 1.16g 固体 |
| A. | HA为强酸 | B. | 该混合液pH=7 | ||
| C. | 该混合溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) | D. | 该混合溶液中:c(A-)+c(OH-)=c(Na+)+c(H+) |
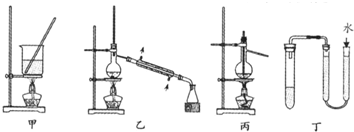
| A. | 用甲装置将海带灼烧成灰 | |
| B. | 分离Na2CO3溶液和CH3COOC2H5,可使用如图乙所示实验装置 | |
| C. | 利用丙装置进行石油分馏 | |
| D. | 利用丁装置检验装置的气密性 |
| A. | Na2SO4 | B. | CO2 | C. | Cl2 | D. | Cu |
| A. | 两种气体的分子个数之比为17:16 | |
| B. | 同温同压下,两种气体的体积之比为17:16 | |
| C. | 两种气体的氢原子个数之比为17:12 | |
| D. | 同温同压下,两种气体的密度之比为17:16 |
 3,4-二甲基-4乙基-庚烷
3,4-二甲基-4乙基-庚烷 3-甲基-丁炔
3-甲基-丁炔 .
.