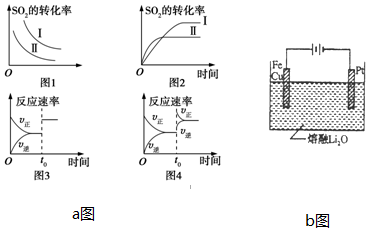
题目内容
19.在生产生活中,我们会遇到各种各样的化学反应.请按要求回答下列问题:(1)Na2O2可用作呼吸面具的供氧剂,发生反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2.
(2)“水玻璃”长期暴露在空气中会变质,这是因为“水玻璃”与空气中的二氧化碳接触,生成了乳白色的凝胶状沉淀(用H2SiO3表示)和碳酸钠的缘故.写出反应的离子方程式SiO32-+H2O+CO2=H2SiO3↓+CO32-.
(3)氯气是一种重要的化工原料.
①实验室通常用氢氧化钠溶液吸收氯气,写出反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
②漂白粉的有效成分是Ca(ClO)2(填化学式);实验室也可用漂白粉与浓盐酸在常温下制备氯气,写出反应化学方程式Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O; 若产生3.36L氯气(标准状况),则转移的电子数为0.3mol,被氧化的HCl的物质的量0.3mol.
分析 (1)过氧化钠与二氧化碳反应生成碳酸钠和氧气,可以做供氧剂;
(2)硅酸钠与二氧化碳、水反应生成碳酸钠和硅酸;
(3)①氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水;
②漂白粉有效成分为次氯酸钙,次氯酸钙与盐酸反应生成氯化钙、氯气和水,依据氯元素化合价变化计算转移电子数,判断被氧化的氯化氢物质的量.
解答 解:(1)过氧化钠与二氧化碳反应生成碳酸钠和氧气,方程式:2Na2O2+2CO2=2Na2CO3+O2;
故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(2)硅酸钠与二氧化碳、水反应生成碳酸钠和硅酸,离子方程式:SiO32-+H2O+CO2=H2SiO3↓+CO32-;
故答案为:SiO32-+H2O+CO2=H2SiO3↓+CO32-;
(3)①氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,离子方程式:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
②漂白粉有效成分为次氯酸钙,化学式Ca(ClO)2,次氯酸钙与盐酸反应生成氯化钙、氯气和水,化学方程式:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O,依据方程式可知:生成1mol氯气,有2mol氯化氢被氧化,转移2mol电子,则产生3.36L氯气(标准状况),物质的量为$\frac{3.36L}{22.4L/mol}$=0.15mol,转移0.3mol电子,有0.3mol氯化氢被氧化;
故答案为:Ca(ClO)2; Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O;0.3mol;0.3mol.
点评 本题考查了化学方程式的书写,明确相关物质的性质及发生反应实质是解题关键,注意氧化还原反应基本概念与规律的应用,题目难度中等.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案| A. | 摩尔质量:mol/g | B. | 物质量:mol | ||
| C. | 溶解度:g/100g | D. | 气体摩尔体积:L/mol |
(1)第1步:灼烧,操作是将足量海带灼烧成灰烬,该过程中将用到的实验仪器除铁架台(有铁圈)、酒精灯、坩埚钳、泥三角外,还有B(填代号);
A.试管B.瓷坩埚C.蒸发皿D.烧杯
(2)第2步:含I-溶液的获取,其操作有溶解和过滤;
A.蒸馏B.分液C.过滤
(3)第3步:证明该溶液中含有I-,请你写出第二种不同的方法(试剂自选)
| 方法 | 选用试剂 | 现象 |
| 第一种(萃取) | 氯水、四氯化碳 | 下层溶液显紫色 |
| 第二种 |
①AlCl3溶液和Al2(SO4)3溶液加热蒸干,所得固体的成分相同
②配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度
③氟化铵溶液不能用玻璃瓶盛装
④泡沫灭火器中常使用的原料是碳酸钠和硫酸铝
⑤明矾可以做净水剂
⑥向碳酸钙中加入氯化铁溶液会产生气体,并能产生红褐色沉淀.
| A. | ②③④⑤ | B. | ③⑤⑥ | C. | ①②③④⑤ | D. | ①②④⑥ |
| A. | +5、4 | B. | +5、7 | C. | +5、5 | D. | +7、7 |
| A. | Cu做还原剂 | B. | H2做氧化剂 | ||
| C. | 铜元素的化合价降低 | D. | 铜是氧化产物 |