题目内容
10.氢气还原氧化铜:CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,在该反应中( )| A. | Cu做还原剂 | B. | H2做氧化剂 | ||
| C. | 铜元素的化合价降低 | D. | 铜是氧化产物 |
分析 CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O中,Cu元素的化合价降低,H元素的化合价升高,以此来解答.
解答 解:A.CuO元素的化合价降低,CuO为氧化剂,Cu为还原产物,故A错误;
B.H元素的化合价升高,则氢气为还原剂,故B错误;
C.Cu元素的化合价由+2价降低为0,故C正确;
D.Cu得到电子杯氧化,则Cu为还原产物,故D错误;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意基本概念的应用,题目难度不大.

练习册系列答案
相关题目
1.下列说法中,正确的是( )
| A. | 分子间作用力越大,分子越稳定 | |
| B. | 气态氢化物共价键越强,热稳定性越高 | |
| C. | 冰融化时水分子中共价键发生断裂 | |
| D. | 氢键是化学键的一种类型 |
18.下列原子中可以形成R+离子的是( )
| A. | 核电荷数为13 | B. | 质子数为17 | ||
| C. | M层比L层少6 | D. | 质量数为23,中子数为12 |
5.下列过程中,既有离子键被破坏,又有共价键被破坏的是( )
| A. | 溴蒸汽被木炭吸附 | B. | 烧碱熔化 | ||
| C. | 碳酸钙高温分解 | D. | HCl溶于水 |
15.关于食物的酸碱性,下列说法中正确的是( )
| A. | 食物溶于水后的溶液中pH<7,则为成酸性食物 | |
| B. | 由碳、氮、硫、磷等元素组成的蛋白质多是酸性食物;蔬菜、水果多是碱性食物 | |
| C. | 大米是碱性食物 | |
| D. | 柠檬是酸性食物 |
2.下列装置或操作(有的夹持装置已省略)正确且能达到目的是( )
| A. | 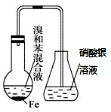 验证苯和液溴在催化剂作用下发生取代反应 | |
| B. | 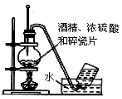 实验室制备并收集乙烯 | |
| C. | 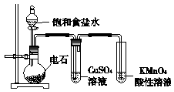 制备乙炔并检验其性质 | |
| D. | 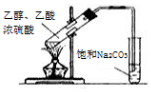 乙醇与乙酸反应制备乙酸乙酯 |
19.欲除去下列物质中混入的少量杂质(括号内物质为杂质),能达到目的是( )
| A. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡静置后,分液 | |
| B. | 苯(苯酚):加入浓溴水,过滤 | |
| C. | 乙醇(水):加入金属钠,蒸馏 | |
| D. | 乙烷(乙烯):通入酸性高锰酸钾溶液,洗气 |
20.下列有关实验原理或操作正确的是( )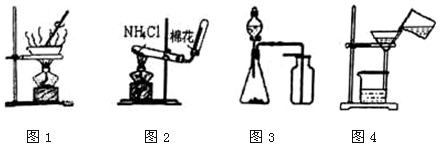

| A. | 用图1所示装置进行食盐溶液的蒸发结晶 | |
| B. | 用图2所示装置在实验室制取少量氨气 | |
| C. | 用图3所示装置制取少量CO2、O2或NO | |
| D. | 用图4所示装置进行固液物质的分离 |