题目内容
3.NA代表阿伏加德罗常数的值,下列说法正确的是( )| A. | 2.3 g钠由原子变成离子时,失去的电子数为1NA | |
| B. | 0.2NA个硫酸分子与19.6 g磷酸含有相同的氧原子数 | |
| C. | 28 g氮气所含原子数为NA | |
| D. | NA个氧分子与NA个氢分子的质量比为2:1 |
分析 A.根据n=$\frac{m}{M}$计算钠的物质的量,每个钠原子失去1个电子形成钠离子,再根据N=nNA计算电子数;
B.硫酸和磷酸摩尔质量相等,而每分子中含有氧原子数相同;
C.氮气是双原子分子;
D.NA个氧分子与NA个氢分子的质量等于摩尔质量之比.
解答 解:A.2.3g钠变成钠离子失去的电子数目为 $\frac{2.3g}{23g/mol}$×1×NAmol-1=0.1NA,故A错误;
B.硫酸和磷酸摩尔质量相等,而每分子中含有氧原子数相同,19.6g磷酸分子数也为0.2NA,故B正确;
B.硫酸和磷酸摩尔质量相等,而每分子中含有氧原子数相同,19.6g磷酸分子数也为0.2NA,故B正确;
C.28g氮气是1mol,含有的原子数为2NA,故C错误;
D.NA个氧分子与NA个氢分子的质量等于摩尔质量之比,即32:2=16:1,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数,完成本题需要熟练掌握有关物质的量与摩尔质量、气体摩尔体积、阿伏伽德罗常数等之间的转化关系,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,33.6L HF中含有氟原子的数目为1.5NA | |
| B. | 常温下,2.7g金属铝与足量浓度为18.4mol/L的浓H2SO4反应时转移的电子数为0.3NA | |
| C. | Na2O与Na2O2的混合物共1mol,阴离子数目为NA | |
| D. | CH4与P4的分子结构都是正四面体,每1mol CH4分子与P4分子都含有4NA个共价键 |
20.设NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 12g石墨烯( 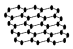 )中含有C-C键的数目为1.5NA )中含有C-C键的数目为1.5NA | |
| B. | 100g质量分数为17%的H2O2水溶液中含氧原子数目为0.5NA | |
| C. | 常温下,1 L0.5 mol/L NH4Cl溶液与2 L0.25 mol/L NH4Cl溶液所含NH4+的数目均为0.5 NA | |
| D. | 在KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O反应中,每生成1 mol Cl2转移的电子数为2NA |
17.有aX和2aY两原子,已知2aY原子的M层比aX原子的核外电子数多1,X原子的最外电子层比Y原子的最外电子层的电子数多1.X元素不可能是下列元素中的哪一种元素( )
| A. | Na | B. | Mg | C. | A1 | D. | Cl |
4.分子式为C10H14且苯环上的一氯代物有两种的有机物有( )
| A. | 3种 | B. | 5种 | C. | 6种 | D. | 7种 |
8.在一密闭容器中发生反应:2A(g)+2B(g)?C(s)+3D(g)△H<0,达到平衡时采取下列措施,可以使正反应速率v正增大、D的物质的量浓度c(D)增大的是( )
| A. | 移走少量C | B. | 扩大容积,减小压强 | ||
| C. | 缩小容积,增大压强 | D. | 容积不变,充入“惰”气 |
15.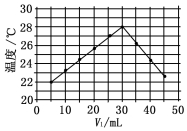 将V1mL 1.0mol•L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1mL 1.0mol•L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
 将V1mL 1.0mol•L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )
将V1mL 1.0mol•L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( )| A. | 做该实验时环境温度为22℃ | |
| B. | 该实验表明可将热能转化为化学能 | |
| C. | NaOH溶液的浓度约为1.5 mol•L-1 | |
| D. | 该实验表明有水生成的反应都是放热反应 |
12.下列说法中错误的是( )
| A. | 根据对角线规则,铍和铝的性质具有相似性 | |
| B. | 在H3O+、NH4+和[Cu(NH3)4]2+中都存在配位键 | |
| C. | O3与SO2的结构相似 | |
| D. | P4和CH4都是正四面体分子且键角都为109°28ˊ |
13.化学与生产和生活密切相关,下列有关说法正确的是( )
| A. | 硅太阳能电池利用的是原电池原理 | |
| B. | 用干燥的钢瓶盛装液氯和用铁制容器盛装容器盛装浓硝酸的原理相同 | |
| C. | 含有活性炭的口罩可阻挡雾霾,其原理是利用活性炭的吸附作用 | |
| D. | 用菜籽油浸泡花椒制得花椒油后,用分液的方法将花椒油分离出来 |