题目内容
 可逆反应A(s)+B(g)?n C (g)△H=Q (n为正整数)在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线如右图所示.下列有关叙述中一定正确的是( )
可逆反应A(s)+B(g)?n C (g)△H=Q (n为正整数)在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线如右图所示.下列有关叙述中一定正确的是( )| A、其他条件相同,a表示使用了催化剂,b没有使用催化剂 |
| B、其他条件相同,若只改变压强,则a比b的压强大且n≥2 |
| C、其他条件相同,若只改变温度,则a比b的温度高且Q>0 |
| D、其他条件相同,a表示减少A的物质的量 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:A、加入催化剂同等程度增大正逆反应速率,平衡不移动;
B、压强越大,平衡时C的百分含量(C%)越小,可知正反应为气体物质的量增大的反应,即1<n;
C、a到达平衡时间短,所以a温度高,再根据升温,平衡移动分析;
D、a表示减少A的物质的量,因为A为固体,改变A的量平衡不移动.
B、压强越大,平衡时C的百分含量(C%)越小,可知正反应为气体物质的量增大的反应,即1<n;
C、a到达平衡时间短,所以a温度高,再根据升温,平衡移动分析;
D、a表示减少A的物质的量,因为A为固体,改变A的量平衡不移动.
解答:
解:A、加入催化剂同等程度增大正逆反应速率,平衡不移动,则a、b到达平衡时C的百分含量相同,故A错误;
B、a到达平衡时间短,所以a压强高,压强越大,平衡时C的百分含量(C%)越小,可知正反应为气体物质的量增大的反应,即1<n,所以a比b的压强大且n≥2,故B正确;
C、a到达平衡时间短,所以a温度高,升温平衡时C的百分含量(C%)减小,平衡逆向移动,所以△H<0,故C错误;
D、a表示减少A的物质的量,因为A为固体,改变A的量平衡不移动,故D错误;
故选B.
B、a到达平衡时间短,所以a压强高,压强越大,平衡时C的百分含量(C%)越小,可知正反应为气体物质的量增大的反应,即1<n,所以a比b的压强大且n≥2,故B正确;
C、a到达平衡时间短,所以a温度高,升温平衡时C的百分含量(C%)减小,平衡逆向移动,所以△H<0,故C错误;
D、a表示减少A的物质的量,因为A为固体,改变A的量平衡不移动,故D错误;
故选B.
点评:本题考查了体积分数随温度、压强变化曲线的分析,难度不大,明确“先拐先平数值大”是解本题的关键,注意D选项中,固体量的多少对化学平衡无影响,即不影响平衡的移动.

练习册系列答案
相关题目
盐酸、醋酸和碳酸氢钠是生活中常见的物质,下列表述正确的是( )
| A、在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO32-和OH- |
| B、将pH相同的盐酸和醋酸稀释相同倍数,醋酸的pH变化大 |
| C、10 mL0.10 mol?L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D、中和体积与pH都相同HCl溶液和CH3COOH溶液所消耗NaOH物质的量相同 |
下列说法正确的是( )
| A、在相同条件下,若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | ||
| B、由“C(石墨)=C(金刚石);△H=+119kJ?mol-1”可知,金刚石比石墨稳定 | ||
| C、在稀溶液中:H+(aq)+OH q)=H2O(l);△H=-57.3l kJ?mol-1,若将含0.5mol H2SO4的浓硫酸与lmol NaOH溶液混合,放出的热量大于57.31 kJ | ||
D、在101KPa时,2g H2生成液态水,放出285.8 kJ 热量,氢气燃烧的热化学方程式表示为:H2(g)+
|
下列物质,按熔点由低到高的顺序排列的是( )
①SiO2、NaCl、Na、CH4;
②NaCl、Na、H2O、CH4;
③F2、Cl2、Br2、I2;
④H2、Na、NaCl、Si.
①SiO2、NaCl、Na、CH4;
②NaCl、Na、H2O、CH4;
③F2、Cl2、Br2、I2;
④H2、Na、NaCl、Si.
| A、①③ | B、②④ | C、①② | D、③④ |
下列电离方程式书写正确的是( )
| A、Ca(OH)2?Ca2++2OH- |
| B、H2SO3?2H++SO32- |
| C、NaHS?Na++HS- |
| D、HCO3-?H++CO32- |
某有机物甲经氧化后得乙(分子式为C2H3O2Cl);而甲经水解可得丙,1mol丙和2mol乙反应的一种含氯的酯(C6H8O4Cl2).由此推断甲的结构简式为( )
| A、HO-CH2-CH2-OH |
B、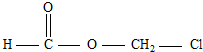 |
C、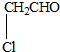 |
D、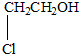 |
在氯化铵溶液中,下列关系式正确的是( )
| A、c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| B、c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| C、c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| D、c(Cl-)>c(NH4+)>c(OH-)>c(H+) |