题目内容
2.下列物质中属于电解质的是( )| A. | 二氧化碳 | B. | 银 | C. | 氯化钠 | D. | 烧碱溶液 |
分析 水溶液中或熔融状态下能够导电的化合物称为电解质,酸、碱、盐都是电解质;在上述两种情况下都不能导电的化合物称为非电解质,大多数的有机物(如蔗糖、乙醇)都是非电解质;单质,混合物既不是电解质也不是非电解质.
解答 解:A.二氧化碳和水反应生成碳酸,碳酸能电离出自由移动的阴阳离子,所以二氧化碳的水溶液导电,但电离出离子的物质是碳酸不是二氧化碳,所以二氧化碳是非电解质,故A错误;
B.银是单质,既不是电解质也不是非电解质,故B错误;
C.氯化钠为离子化合物,在水溶液中或熔融状态下能导电是电解质,故C正确;
D.烧碱溶液为混合物,既不是电解质也不是非电解质,故D错误;
故选C.
点评 本题考查了电解质与非电解质的判断,题目难度不大,明确电解质与非电解质的概念为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
7.下列有机物既能发生加成反应,又能发生消去反应的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
11.下列化合物分子中的所有原子都处于同一平面的是( )
| A. | 间二溴苯 | B. | 对二甲苯 | C. | 丙炔 | D. | 1,4-戊二烯 |
12.已知:C (s)+0.5O2(g)═CO(g) H=-110.50KJ/mol
C(s)+O2(g)═CO2(g) H=-393.51KJ/mol
则反应C (s)+CO2(g)═2CO(g)的△H为( )
C(s)+O2(g)═CO2(g) H=-393.51KJ/mol
则反应C (s)+CO2(g)═2CO(g)的△H为( )
| A. | -283.01KJ/mol | B. | +172.51 KJ/mol | C. | +283.01KJ/mol | D. | -504.01 KJ/mol |
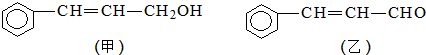
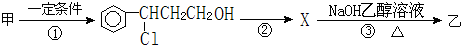
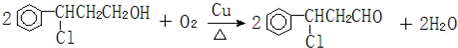 (注明反应条件).
(注明反应条件).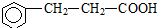 ).写出同时符合下列要求的丙的同分异构体结构简式
).写出同时符合下列要求的丙的同分异构体结构简式 、
、 ,.
,.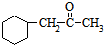 )的流程如图:
)的流程如图: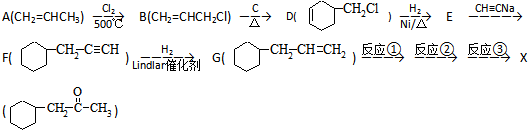 )
)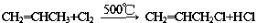 ;写出反应③的化学方程式
;写出反应③的化学方程式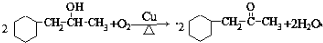 ;
;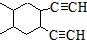 合成线路(其他试剂任选).
合成线路(其他试剂任选). A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.
A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.