题目内容
10.四种短周期元素在周期表中的相对位置如表格所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.| X | Y | |
| Z | W |
(1)元素Z位于周期表中的位置第3周期第ⅤA族
(2)这些元素的氢化物中,水溶液碱性最强的是NH3(填写化学式,下同);X、Y、Z三种 元素的最高价氧化对应水化物中酸性由强到弱的依次为HNO3>H3PO4>H2CO3
(3)Y的气态氢化物和其最高价氧化物对应的水化物相互反应的离子方程式为:NH3+H+=NH4+.
分析 由短周期元素在周期表的位置可知,Z为第三周期元素,Z元素原子核外电子总数是其最外层电子数的3倍,设最外层电子数为x,则3x=(2+8)+x,解得x=5,则Z为P,结合元素在周期表的位置可知,X为C,Y为N,W为Cl,以此来解答.
解答 解:由上述分析可知,X为C,Y为N,Z为P,W为Cl,
(1)元素Z位于周期表中的位置为第3周期第ⅤA族,故答案为:第3周期第ⅤA族;
(2)氨气的水溶液电离显碱性,非金属性越强,素的最高价氧化对应水化物中酸性越强,则这些元素的氢化物中,水溶液碱性最强的是NH3,X、Y、Z三种元素的最高价氧化对应水化物中酸性由强到弱的依次为HNO3>H3PO4>H2CO3,
故答案为:NH3;HNO3;H3PO4;H2CO3;
(3)Y的气态氢化物和其最高价氧化物对应的水化物相互反应的离子方程式为NH3+H+=NH4+,故答案为:NH3+H+=NH4+.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、原子结构来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
12.在花瓶中插上一束美丽的鲜花,将会给你紧张而又忙碌的学习、生活带来轻松和愉悦的心情.可是过不了几天,花儿就会枯萎.如果在花瓶中加入“鲜花保鲜剂”,就会延长鲜花的寿命.表是1L“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是A(填字母).
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)“鲜花保鲜剂”中的K+的物质的量浓度约为(阿司匹林中不含K+)8.91×10-3mol/L
(3)配制上述1L“鲜花保鲜剂”所需的仪器有:量筒、烧杯、玻璃棒、托盘天平、药匙、胶头滴管,1000mL容量瓶.(填所缺仪器的名称).
(4)在溶液配制过程中,下列操作对配制结果没有影响的是BD(填字母).
A.定容用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度线相切
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(5)实验室用固体加热制氨气的化学反应方程式为:2NH4Cl+Ca(OH)$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
(6)若将收集到的氨气溶于水配成100mL的溶液,所得氨水中NH3物质量浓度(不考虑NH3与H2O的反应)为0.3mol•L-1,则需要氨气的体积为672mL(标准状况).
| 成 分 | 质 量(g) | 摩尔质量(g/mol) |
| 蔗糖 | 50.00 | 342 |
| 硫酸钾 | 0.50 | 174 |
| 阿司匹林 | 0.35 | 180 |
| 高锰酸钾 | 0.50 | 158 |
| 硝酸银 | 0.04 | 170 |
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)“鲜花保鲜剂”中的K+的物质的量浓度约为(阿司匹林中不含K+)8.91×10-3mol/L
(3)配制上述1L“鲜花保鲜剂”所需的仪器有:量筒、烧杯、玻璃棒、托盘天平、药匙、胶头滴管,1000mL容量瓶.(填所缺仪器的名称).
(4)在溶液配制过程中,下列操作对配制结果没有影响的是BD(填字母).
A.定容用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度线相切
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(5)实验室用固体加热制氨气的化学反应方程式为:2NH4Cl+Ca(OH)$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
(6)若将收集到的氨气溶于水配成100mL的溶液,所得氨水中NH3物质量浓度(不考虑NH3与H2O的反应)为0.3mol•L-1,则需要氨气的体积为672mL(标准状况).
13.镁铝组成的混合物平均分成两份,一份与足量氢氧化钠溶液反应,另一份与足量稀盐酸反应,产生氢气的质量前者是后者的二分之一,则混合物中镁铝的质量比是( )
| A. | 1:1 | B. | 3:4 | C. | 4:3 | D. | 3:2 |
10.常温下,电解质溶液中的下列关系式不正确的是( )
| A. | 已知A-+H2B(过量)=HA+HB-,则结合H+的能力:HB-<A-<B2- | |
| B. | 在0.1 mol•L-1的氨水中滴加0.1 mol•L-1盐酸,恰好完全中和时,c(NH4+)+c(NH3•H2O)=0.05mol•L-1 | |
| C. | 将c mol•L-1 的醋酸溶液与0.02 mol•L-1NaOH溶液等体积混合后恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=$\frac{2×1{0}^{-9}}{c-0.02}$ | |
| D. | 将0.2mol•L-1盐酸与0.1mol•L-1的KAlO2溶液等体积混合,溶液中离子浓度由大到小的顺序:c(Cl-)>c(K+)>c(Al3+)>c(H+)>c(OH-) |
5.运用化学反应原理研究NH3的性质具有重要意义.请回答下列问题:
(1)氨气可以构成燃料电池,其电池反应原理为4NH3+3O2═2N2+6H2O.NH3应通入燃料电池的负极(填“正极”或“负极”).已知电解质溶液为KOH溶液,正极的电极反应式为O2+2H2O+4e-=4OH-.
(2)25℃时,将a mol•L-1的氨水与0.1mol•L-1的盐酸等体积混合.
①当溶液中离子浓度关系满足c(NH4+)>c(Cl-)时,则反应的情况可能为a.
a.盐酸不足,氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
②当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3•H2O的电离常数Ka=$\frac{1{0}^{-8}}{a-0.1}$.
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3H2(g)?2NH3(g)△H=bkJ•mol-1,其化学平衡常数K与温度的关系如下:
①写出该反应的化学平衡常数的表达式:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$,b小于(填“大于”“小于”或“等于”)0.
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的v正(N2)小于(填“大于”“小于”或“等于”)v逆(N2).
(4)已知:
①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8kJ/mol.
(1)氨气可以构成燃料电池,其电池反应原理为4NH3+3O2═2N2+6H2O.NH3应通入燃料电池的负极(填“正极”或“负极”).已知电解质溶液为KOH溶液,正极的电极反应式为O2+2H2O+4e-=4OH-.
(2)25℃时,将a mol•L-1的氨水与0.1mol•L-1的盐酸等体积混合.
①当溶液中离子浓度关系满足c(NH4+)>c(Cl-)时,则反应的情况可能为a.
a.盐酸不足,氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
②当溶液中c(NH4+)=c(Cl-)时,用含a的代数式表示NH3•H2O的电离常数Ka=$\frac{1{0}^{-8}}{a-0.1}$.
(3)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3H2(g)?2NH3(g)△H=bkJ•mol-1,其化学平衡常数K与温度的关系如下:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.85 | 0.5 |
②400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的v正(N2)小于(填“大于”“小于”或“等于”)v逆(N2).
(4)已知:
①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8kJ/mol.
19.t℃时,相对分子质量为A的某物质的饱和溶液,其物质的量浓度为Bmol•L-1,密度为ρg•cm-3,则该物质在t℃时溶解度为( )
| A. | $\frac{100AB}{1000ρ-AB}$g | B. | $\frac{AB}{1000ρ-AB}×100%$g | ||
| C. | $\frac{AB}{100ρ}×100$g | D. | $\frac{100AB}{ρ-AB}$g |
20.用惰性电极电解CuSO4溶液一段时间后,停止电解,向所得溶液中加入0.1molCu2(OH)2CO3,溶液浓度恢复至电解前,关于该电解过程的说法不正确的是( )
| A. | 生成Cu的物质的量是0.2mol | B. | 转移电子的物质的量是0.4mol | ||
| C. | 随着电解的进行溶液的pH减小 | D. | 阳极反应是2H2O-4e-=4H++O2↑ |
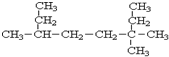 3,3,6-三甲基辛烷
3,3,6-三甲基辛烷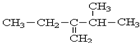 3-甲基-2-乙基-1-丁烯
3-甲基-2-乙基-1-丁烯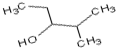 2-甲基-3-戊醇.
2-甲基-3-戊醇.