题目内容
下列有关实验操作正确的是( )
A、 称量氢氧化钠固体 |
B、 检验铁粉与水蒸气反应产生的氢气 |
C、 配制175 mL 0.10 mol?L-1盐酸 |
D、 分离两种互溶但沸点相差较大的液体混合物 |
考点:化学实验方案的评价
专题:
分析:A.称量时,药瓶放在左盘,砝码在右盘;
B.Fe与水蒸气反应生成四氧化三铁和氢气,点燃肥皂泡验证氢气;
C.不能用100mL容量瓶配制175 mL 溶液;
D.水的进出方向错误.
B.Fe与水蒸气反应生成四氧化三铁和氢气,点燃肥皂泡验证氢气;
C.不能用100mL容量瓶配制175 mL 溶液;
D.水的进出方向错误.
解答:
解:A.称量时,药瓶放在左盘,砝码在右盘,且将氢氧化钠放在小烧杯中称量,故A错误;
B.Fe与水蒸气反应生成四氧化三铁和氢气,点燃肥皂泡验证氢气,图中实验装置及方案合理,故B正确;
C.容量瓶较小,不能用100mL容量瓶配制175 mL 溶液,故C错误;
D.水的进出方向错误,应从下端进水,故D错误.
故选B.
B.Fe与水蒸气反应生成四氧化三铁和氢气,点燃肥皂泡验证氢气,图中实验装置及方案合理,故B正确;
C.容量瓶较小,不能用100mL容量瓶配制175 mL 溶液,故C错误;
D.水的进出方向错误,应从下端进水,故D错误.
故选B.
点评:本题考查化学实验方案的评价,为高频考点,涉及溶液配制、固体称量、物质的检验等,把握实验操作的规范性、实验细节和实验原理为解答的关键,注意方案的合理性、评价性、操作性分析,选项B为解答的难点,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
在一定条件下,合成氨反应N2+3H2?2NH3达到平衡时,有50%H2转化为NH3,若N2的转化率为25%,则起始时充入容器中的N2和H2的物质的量之比为( )
| A、3:2 | B、1:2 |
| C、1:3 | D、2:3 |
茶叶中铁元素的检验可经过以下四个步骤完成:将茶叶灼烧灰化→用浓硝酸溶解茶叶灰→过滤得到的滤液→检验滤液中的Fe3+.如图是可能用到的实验用品.
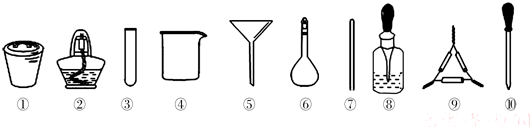
有关该实验的说法中正确的是( )

有关该实验的说法中正确的是( )
| A、第一步需选用仪器①、②和⑨,①的名称叫钳埚 |
| B、第二步用浓硝酸溶解茶叶并加蒸馏水稀释,选用④、⑥和⑦ |
| C、要完成第三步,需选用④、⑤和⑦,除夹持仪器外还缺滤纸 |
| D、第四步,若滤液中含有Fe3+,加入⑧中的溶液后滤液会显红色 |
下列变化不属于取代反应的是( )
A、CH3COO C2H5+H2O
| ||
B、CH2=CH2+H2
| ||
C、 +HNO3 +HNO3
 +H2O +H2O | ||
D、CH4+Cl2
|
短周期元素X、Y、Z,其中X、Z同主族,Y、Z同周期,Z原子最外层电子数是X原子内层电子数的3倍,是Y原子最外层电子数的2倍.下列说法错误的是( )
| A、Y位于第3周期 |
| B、含X、Z的酸不只一种 |
| C、原子半径:Y>Z |
| D、气态氢化物稳定性:Z>X |
下列叙述中正确的是( )
| A、将KI和FeCl3溶液棍合,溶液变棕黄色,说明还原性Fe2+>I- |
| B、NO2通入FeSO4溶液中的过程中由浅绿色变为黄色 |
| C、能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2 |
| D、SO2通入BaCl2溶液中先有白色沉淀后沉淀溶解 |


 由短周期元素组成的甲、乙和丙均为中学常见物质,一定条件下,它们存在如下转化关系:
由短周期元素组成的甲、乙和丙均为中学常见物质,一定条件下,它们存在如下转化关系: