题目内容
2.下列说法中错误的是( )| A. | 键能:F-F>Cl-Cl>Br-Br>I-I | |
| B. | 键长:F-F<Cl-Cl<Br-Br<I-I | |
| C. | 苯、CO2是非极性分子,甲醛是极性分子 | |
| D. | 苯和B3N3H6互为等电子体 |
分析 A.气态基态原子形成1mol化学键释放的最低能量就是该共价键的键能,键能与成键原子间的核间距、以及同种电荷排斥力有关;
B.同周期从上往下,半径逐渐增大,原子半径越大,共价键键长越大;
C.极性分子中正负电荷的中心不重合,具有一定的极性,极性分子是由极性键构成的结构不对称的分子;
D.价电子总数相等,原子数也相等互为等电子体.
解答 解:A.F-F的键长短原子核距离近,同种电荷排斥力强,势能大使内能也较大,Cl-Cl键,原子核距离远,同种电荷排斥力小,势能小使内能也较小,所以键能:F-F<Cl-Cl,故A错误;
B.F、Cl、Br、I属于同一主族,从上到下原子半径增大,则原子半径:F<Cl<Br<I,原子半径越大,共价键键长越大,则共价键的键长:F-F<Cl-Cl<Br-Br<I-I,故B正确;
C.二氧化碳,平面直线型结构,空间结构对称,正负电荷的中心重合,属于非极性分子,苯为平面正六边形,空间结构对称是非极性分子,甲醛分子的空间结构不对称属于极性分子,故C正确;
D.苯与B3N3H6价电子总数相等,原子数也相等互为等电子体,故D正确;
故选A.
点评 本题考查微粒性质的比较,涉及键能、键长的比较、极性分子的判断、等电子体等,涉及知识点较多,注重高频考点的考查,注意归纳规律性知识,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 标准状况下,2.24L苯中含有碳碳双键的数目为0.3NA | |
| B. | 标准状况下,22.4LC12与某物质充分反应,一定转移NA个电子 | |
| C. | 1L0.1mol•L-1的HF溶液中含有的分子数一定大于0.1NA | |
| D. | 含有10.7gFe(OH)3的氢氧化铁胶体中胶粒总数为0.1NA |
10.下列物质中,含有极性键的离子化合物是( )
| A. | CaCl2 | B. | Na2O2 | C. | NaOH | D. | K2S |
14.可逆反应A(g)+B(s)?C(g)+D(g)在恒温恒容的密闭容器中进行,下列选项中不能说明该反应已经达到平衡状态的是( )
| A. | 消耗amolA物质的同时消耗amolC物质 | |
| B. | 混合气体的质量不再改变 | |
| C. | B物质的浓度不再改变 | |
| D. | 容器内的压强不再改变 |
11.2015年10月5日,屠呦呦因发现治疗疟疾的青蒿素和双氢青蒿素(结构如图)获得诺贝尔生理学或医学奖.一定条件下青蒿素可以转化为双氢青蒿素.下列有关说法中正确的是( )


| A. | 青蒿素的分子式为C15H20O5 | |
| B. | 1 mol青蒿素最多能和1 molBr2发生加成反应 | |
| C. | 双氢青蒿素能发生氧化反应、酯化反应 | |
| D. | 青蒿素转化为双氢青蒿素发生了氧化反应 |
12.在自然界存在游离态的元素是( )
| A. | 硫 | B. | 氯 | C. | 铝 | D. | 镁 |


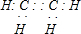
 CH3COOC2H5+H2O
CH3COOC2H5+H2O 木糖的分子式为C5H10O5,属于多羟基醛,木糖在浓硫酸作用下生成糠醛(结构简式如图).
木糖的分子式为C5H10O5,属于多羟基醛,木糖在浓硫酸作用下生成糠醛(结构简式如图). .
.