题目内容
14.可逆反应A(g)+B(s)?C(g)+D(g)在恒温恒容的密闭容器中进行,下列选项中不能说明该反应已经达到平衡状态的是( )| A. | 消耗amolA物质的同时消耗amolC物质 | |
| B. | 混合气体的质量不再改变 | |
| C. | B物质的浓度不再改变 | |
| D. | 容器内的压强不再改变 |
分析 可逆反应A(g)+B(s)?C(g)+D(g)达到平衡状态时,正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断.
解答 解:A.消耗amolA物质的同时消耗amolC物质,表明正逆反应速率相等,说明已经达到了平衡状态,故A错误;
B.该反应前后气体的质量不相等,若混合气体的质量不再改变,说明该反应已经达到平衡状态,故B错误;
C.B为固体,B物质的浓度不再改变,不能说明该反应已经达到平衡状态,故C正确;
D.该反应前后气体体积不相等,容器内的压强不再改变,说明正逆反应速率相等,证明该反应已经达到平衡状态,故D错误;
故选C.
点评 本题考查了化学平衡状态的判断,题目难度不大,明确化学平衡状态的特征为解答关键,注意掌握影响化学反应速率的因素,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.下列分析及判断中正确的是( )
| A. | 常温下0.1mol•L-1醋酸溶液pH=a,将溶液稀释到原体积的10倍pH=a+1 | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012溶液中:NH4+、Al3+、NO3-、Cl-可以大量共存 | |
| C. | CO2分子中,碳氧键为极性键,正电荷中心和负电荷中心不重合,为极性分子 | |
| D. | pH=8.0的溶液中,CO2的主要存在形态为CO32- |
5.下列各组离子在溶液中能大量共存的是( )
| A. | NH4+ SO42- NO3- | B. | Ba2+ SO42- NO3- | ||
| C. | Na+ H+ CO32- | D. | Cu2+ OH- Cl- |
2.下列说法中错误的是( )
| A. | 键能:F-F>Cl-Cl>Br-Br>I-I | |
| B. | 键长:F-F<Cl-Cl<Br-Br<I-I | |
| C. | 苯、CO2是非极性分子,甲醛是极性分子 | |
| D. | 苯和B3N3H6互为等电子体 |
9.下列有关表述错误的是( )
| A. | IBr的电子式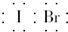 | B. | HClO的结构式为H-O-Cl | ||
| C. | HIO各原子都满足8电子结构 | D. | NaBr的形成过程可以表示为: |
4.下列化学用语正确的是( )
| A. | 二氧化硅的分子式:SiO2 | B. | 甲基的电子式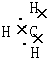 | ||
| C. | 水分子的结构式:H-O-H | D. | Na2O2中阴,阳离子数之比为1:1 |
 .
. +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$ +2H2O.
+2H2O. +2nNaOH$→_{△}^{Cu}$n
+2nNaOH$→_{△}^{Cu}$n +n
+n .+nH2O.
.+nH2O.
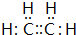 .
.