题目内容
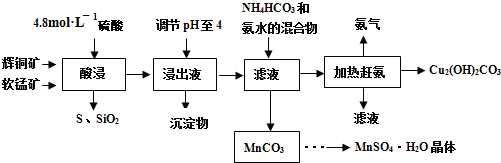
锂离子电池的应用很广,其正极材料可再生利用.某锂离子电池正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑和铝箔等.充电时,该锂离子电池负极发生的反应为6C+xLi++xe-═LixC6.现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出).
同答下列问题:

(1)LiCoO2中,Co元素的化合价为 .
(2)写出“正极碱浸”中发生反应的离子方程式 .
(3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式 、 .
(4)写出“沉钴”过程中发生反应的化学方程式 .
(5)充放电过释中,发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池反应方程式 .
(6)在整个回收工艺中,可回收到的金属化合物有 (填化学式).
同答下列问题:

(1)LiCoO2中,Co元素的化合价为
(2)写出“正极碱浸”中发生反应的离子方程式
(3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式
(4)写出“沉钴”过程中发生反应的化学方程式
(5)充放电过释中,发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池反应方程式
(6)在整个回收工艺中,可回收到的金属化合物有
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:废旧锂离子电池放电处理拆解后正极用氢氧化钠溶液碱溶过滤得到滤液调节溶液PH过滤得到氢氧化铝沉淀;滤渣加入硫酸,过氧化氢调节溶液PH过滤得到滤液加入萃取剂萃取分液得到水层为硫酸锂,有机层通过反萃取得到水层硫酸钴溶液加入碳酸氢铵溶液沉淀钴离子得到碳酸钴固体;
(1)根据化合物中,化合价的代数和为0判断;
(2)碱浸正极时,铝和氢氧根离子反应生成偏铝酸根离子和氢气;
(3)根据所加入的反应物以及生成物结合质量守恒定律来书写化学方程式;由题中信息知LiCoO2具有强氧化性,加入过氧化氢调节溶液PH;
(4)“沉钴”过程中硫酸钴和碳酸氢铵反应生成碳酸钴沉淀;
(5)放电时,Li1-xCoO2和LixC6发生氧化还原反应生成LiCoO2和C;
(6)“放电处理”有利于锂在正极的回收,Li+从负极中脱出,经由电解质向正极移动,在整个回收工艺中,可回收到的金属化合物有Al(OH)3、CoCO3、Li2SO4.
(1)根据化合物中,化合价的代数和为0判断;
(2)碱浸正极时,铝和氢氧根离子反应生成偏铝酸根离子和氢气;
(3)根据所加入的反应物以及生成物结合质量守恒定律来书写化学方程式;由题中信息知LiCoO2具有强氧化性,加入过氧化氢调节溶液PH;
(4)“沉钴”过程中硫酸钴和碳酸氢铵反应生成碳酸钴沉淀;
(5)放电时,Li1-xCoO2和LixC6发生氧化还原反应生成LiCoO2和C;
(6)“放电处理”有利于锂在正极的回收,Li+从负极中脱出,经由电解质向正极移动,在整个回收工艺中,可回收到的金属化合物有Al(OH)3、CoCO3、Li2SO4.
解答:
解:(1)根据化合物中,化合价的代数和为0知,LiCoO2中,Co元素的化合价为+3价,故答案为:+3;
(2)正极中含有铝,铝易溶于强碱溶液生成AlO2-,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)酸浸时反应物有硫酸、过氧化氢以及LiCoO2,生成物有Li2SO4和CoSO4,反应方程式为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O,由题中信息知LiCoO2具有强氧化性,加入过氧化氢发生的 反应为:2H2O2
2H2O+O2↑;
故答案为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O,2H2O2
2H2O+O2↑;
(4)“沉钴”过程中硫酸钴和碳酸氢铵反应生成碳酸钴沉淀、硫酸铵、二氧化碳和水,反应方程式为CoSO4+2NH4HCO3=CoCO3↓+(NH4)2SO4+CO2↑+H2O,
故答案为:CoSO4+2NH4HCO3=CoCO3↓+(NH4)2SO4+CO2↑+H2O;
(5)充放电过程中,Li1-xCoO2和LixC6发生氧化还原反应生成LiCoO2和C,反应方程式为:Li1-xCoO2+LixC6=LiCoO2+6C,
故答案为:Li1-xCoO2+LixC6=LiCoO2+6C;
(6)放电时,负极上生成锂离子,锂离子向正极移动并进入正极材料中,所以“放电处理”有利于锂在正极的回收,根据流程图知,可回收到的金属化合物有Al(OH)3、CoCO3、Li2SO4,
故答案为:Al(OH)3、CoCO3、Li2SO4;
(2)正极中含有铝,铝易溶于强碱溶液生成AlO2-,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)酸浸时反应物有硫酸、过氧化氢以及LiCoO2,生成物有Li2SO4和CoSO4,反应方程式为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O,由题中信息知LiCoO2具有强氧化性,加入过氧化氢发生的 反应为:2H2O2
| ||
故答案为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O,2H2O2
| ||
(4)“沉钴”过程中硫酸钴和碳酸氢铵反应生成碳酸钴沉淀、硫酸铵、二氧化碳和水,反应方程式为CoSO4+2NH4HCO3=CoCO3↓+(NH4)2SO4+CO2↑+H2O,
故答案为:CoSO4+2NH4HCO3=CoCO3↓+(NH4)2SO4+CO2↑+H2O;
(5)充放电过程中,Li1-xCoO2和LixC6发生氧化还原反应生成LiCoO2和C,反应方程式为:Li1-xCoO2+LixC6=LiCoO2+6C,
故答案为:Li1-xCoO2+LixC6=LiCoO2+6C;
(6)放电时,负极上生成锂离子,锂离子向正极移动并进入正极材料中,所以“放电处理”有利于锂在正极的回收,根据流程图知,可回收到的金属化合物有Al(OH)3、CoCO3、Li2SO4,
故答案为:Al(OH)3、CoCO3、Li2SO4;
点评:本题为生产流程题,涉及金属的回收、环境保护、氧化还原反应、物质的分离提纯和除杂等问题,题目较为综合,做题时注意仔细审题,从题目中获取关键信息,难度中等,难点是电极反应式的书写.

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目
下列家庭小实验不能制得溶液的是( )
A、 食盐 |
B、 饱和FeCl3溶液 |
C、 蔗糖 |
D、 碘 |
下列金属中,既属于有色金属又属于轻金属的是( )
| A、铁 | B、铬 | C、钠 | D、银 |
 2014年8月28日,第二届夏季青年奥林匹克运动会(以下简称“青奥会”)在南京奥体中心顺利闭幕.请完成下列与“青奥会”有关的填空.
2014年8月28日,第二届夏季青年奥林匹克运动会(以下简称“青奥会”)在南京奥体中心顺利闭幕.请完成下列与“青奥会”有关的填空.