题目内容
14.用稀的碱性溶液或清水浸泡,可使残留在蔬菜上的农药降低毒性.如用碱性溶液浸泡蔬菜,可在水中加入适量的( )| A. | 白酒 | B. | 纯碱 | C. | 白糖 | D. | 食醋 |
分析 根据盐的酸碱性判断,强碱弱酸盐水解显碱性,据此分析.
解答 解:用碱性溶液浸泡蔬菜,在溶液中显弱碱性该物质为强碱弱酸盐,选项中只有纯碱属于强碱弱酸盐,溶于水显碱性,故B正确;
故选B.
点评 本题考查了盐的水解的应用,题目难度不大,注意把握盐的水解原理以及在生活中的应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列说法正确的是( )
| A. | 甲烷的标准燃烧热为-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 Mpa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的△H不同 | |
| D. | 101 kPa时,硫的标准燃烧热与硫完全燃烧时的物质的量无关 |
2.常温下,下列溶液中离子浓度关系表达正确的是( )
| A. | Na2CO3溶液中:c(H+)+c(Na+)=c(OH-)+c(CO32-)+c(HCO3- ) | |
| B. | 0.1mol/L 的 Na2CO3 溶液中:c(Na+)>c(CO32-)>c(OH- )>c(HCO3-) | |
| C. | pH=5.3 的 NaHSO3 溶液:c(Na+ )>c(HSO3 -)>c(H2SO3)>c(SO32- ) | |
| D. | pH=3 的 CH3COOH 溶液与 pH=11 的 NaOH 溶液等体积混合后:c(Na+)>c(CH3COO-) |
9.关于下列各图的叙述不正确的是( )
| A. | 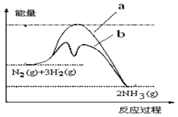 图中曲线b表示工业合成氨中加入铁触媒(催化剂)的能量变化曲线 | |
| B. | 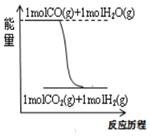 根据图可知在该条件下:CO2(g)+H2(g)═CO(g)+H2O(g)△H<0 | |
| C. |  图中曲线表示向1.0 mol•L-1的醋酸溶液中通入氨气,溶液导电能力的变化情况 | |
| D. |  图中曲线表示常温下向弱酸HA的稀溶液中加水稀释时,c(HA)/c(A-)的变化情况 |
19.对于常温下pH=3的乙酸溶液,下列说法正确的是( )
| A. | 与等体积、pH=3的盐酸比较,跟足量锌粒反应产生的H2更多 | |
| B. | 水稀释到原体积的10倍后,溶液pH变为4 | |
| C. | 加入少量乙酸钠固体,溶液pH降低 | |
| D. | 加水稀释后,溶液中c(H+)和c(OH-)都减小 |
6.下列物质的俗名与化学式相对应的是( )
| A. | 生石灰-Ca(OH)2 | B. | 石膏-Na2SO4•10H2O | ||
| C. | 水玻璃-Na2SiO3水溶液 | D. | 纯碱-NaOH |
3.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 在水溶液中:H+、I-、NO3-、SiO32- | |
| B. | 饱和氯水中:Cl-、NO3-、Na+、SO3- | |
| C. | 将足量CO2通入时:H+、NH4+、Al3+、SO42- | |
| D. | 加入金属铝产生H2的溶液中:NH4+、Na+、SO42-、CH3COO- |
4.下列关于漂白粉的叙述正确的是( )
| A. | 漂白粉的有效成分是Ca(ClO)2 | |
| B. | 漂白粉暴露在空气中久置不会变质 | |
| C. | 漂白粉是由Cl2与石灰乳制得 | |
| D. | 漂白粉变质过程中不涉及氧化还原反应 |