题目内容
2.常温下,下列溶液中离子浓度关系表达正确的是( )| A. | Na2CO3溶液中:c(H+)+c(Na+)=c(OH-)+c(CO32-)+c(HCO3- ) | |
| B. | 0.1mol/L 的 Na2CO3 溶液中:c(Na+)>c(CO32-)>c(OH- )>c(HCO3-) | |
| C. | pH=5.3 的 NaHSO3 溶液:c(Na+ )>c(HSO3 -)>c(H2SO3)>c(SO32- ) | |
| D. | pH=3 的 CH3COOH 溶液与 pH=11 的 NaOH 溶液等体积混合后:c(Na+)>c(CH3COO-) |
分析 A.根据碳酸钠溶液中的电荷守恒分析;
B.碳酸根离子部分水解,溶液呈碱性,结合企业广告离子还来自水的电离分析;
C.亚硫酸氢钠溶液的pH=5.3,说明亚硫酸氢根离子的电离程度大于其水解程度,则c(SO32-)>c(H2SO3);
D.反应后醋酸过量,混合液呈酸性,则c(H+)>c(OH-),结合电荷守恒判断.
解答 解:A.Na2CO3溶液中,根据电荷守恒可知:c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(HCO3-),故A错误;
B.0.1mol/L 的 Na2CO3 溶液中、碳酸根离子部分水解,溶液呈碱性,由于氢氧根离子还来自水的电离,则c(OH- )>c(HCO3-),溶液中离子浓度大小为:c(Na+)>c(CO32-)>c(OH- )>c(HCO3-),故B正确;
C.NaHSO3 溶液呈酸性,说明HSO3-的电离程度大于其水解程度,则c(SO32-)>c(H2SO3),溶液中正确的离子浓度大小为:c(Na+ )>c(HSO3-)>c(SO32-)>c(H2SO3),故C错误;
D.pH=3 的 CH3COOH 溶液与 pH=11 的 NaOH溶液等体积混合后,由于醋酸为弱酸,则醋酸过量,混合液呈酸性:c(H+)>c(OH-),根据电荷守恒可知:c(Na+)<c(CH3COO-),故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理及其影响为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的分析能力及逻辑推理能力.

练习册系列答案
相关题目
3.在某无色透明的酸性溶液中,能共存的离子组是( )
| A. | Na+、Mg2+、Cl-、OH- | B. | H+、Ca2+、Na+、NO3- | ||
| C. | Cu2+、K+、SO42-、NO3- | D. | Na+、SO42-、OH-、Ca2+ |
17.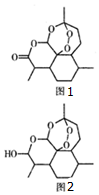 2011年9月12日,中国科学家屠呦呦获拉斯克一狄贝基临床医学研究奖,以表彰她发现了一种药物--青蒿素,它是由菊科植物在低温条件下提炼出来的一种化合物,是治疗疟疾的特效药,其结构筒式如图1所示.下列有关青蒿素的说法错误的是( )
2011年9月12日,中国科学家屠呦呦获拉斯克一狄贝基临床医学研究奖,以表彰她发现了一种药物--青蒿素,它是由菊科植物在低温条件下提炼出来的一种化合物,是治疗疟疾的特效药,其结构筒式如图1所示.下列有关青蒿素的说法错误的是( )
 2011年9月12日,中国科学家屠呦呦获拉斯克一狄贝基临床医学研究奖,以表彰她发现了一种药物--青蒿素,它是由菊科植物在低温条件下提炼出来的一种化合物,是治疗疟疾的特效药,其结构筒式如图1所示.下列有关青蒿素的说法错误的是( )
2011年9月12日,中国科学家屠呦呦获拉斯克一狄贝基临床医学研究奖,以表彰她发现了一种药物--青蒿素,它是由菊科植物在低温条件下提炼出来的一种化合物,是治疗疟疾的特效药,其结构筒式如图1所示.下列有关青蒿素的说法错误的是( )| A. | 青蒿素耐高温且易溶于水不易溶于乙醚、乙酸乙酯等有机溶剂 | |
| B. | 青蒿素分子内的1个过氧基团是对付疟原虫的核心基团 | |
| C. | 1mol青蒿素分子在碱性条件下彻底水解需消耗1mol分子水 | |
| D. | 药效比青蒿素高10倍的双氢青蒿素(见图2)化学式为C15H24O5 |
7.氯化铜晶体在工业上可用作木材防腐剂,媒染剂等.现有含少量FeCl2的酸性CuCl2溶液,为得到纯净的CuCl2•2H2O晶体,某研究小组按如图步骤进行提纯:

已知:相关物质的溶度积常数如表:
(1)最适合作氧化剂X的是d(填字母),加入X的目的是将Fe2+氧化成Fe3+,便于生成沉淀与Cu2+分离.
a.HNO3 b.NaClO c.KMnO4d.H2O2
(2)①为使Fe3+完全除去而不损失Cu2+的目的,加入的物质Y可以是CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3(填化学式).
②调节至pH为3时,铁离子刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续调节至pH为4时,Cu2+开始沉淀(假定Cu2+浓度为3.0mol•L-1).
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.38g试样溶于水,加入过量KI固体,充分反应生成白色沉淀.用0.1000mol•L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL. (已知:2Cu2++4I-═2CuI↓+I2I2+2S2O32-═S4O62-+2I-)
①可选用淀粉溶液作滴定指示剂.
②达到滴定终点时,俯视滴定管读数将使测定结果偏低(填“偏高”、“偏低”或“无影响”).
③该试样中CuCl2•2H2O的质量百分含量为90%.

已知:相关物质的溶度积常数如表:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 3.0×10-20 | 1.0×10-38 | 1.7×10-7 | 1.3×10-12 |
a.HNO3 b.NaClO c.KMnO4d.H2O2
(2)①为使Fe3+完全除去而不损失Cu2+的目的,加入的物质Y可以是CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3(填化学式).
②调节至pH为3时,铁离子刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续调节至pH为4时,Cu2+开始沉淀(假定Cu2+浓度为3.0mol•L-1).
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.38g试样溶于水,加入过量KI固体,充分反应生成白色沉淀.用0.1000mol•L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL. (已知:2Cu2++4I-═2CuI↓+I2I2+2S2O32-═S4O62-+2I-)
①可选用淀粉溶液作滴定指示剂.
②达到滴定终点时,俯视滴定管读数将使测定结果偏低(填“偏高”、“偏低”或“无影响”).
③该试样中CuCl2•2H2O的质量百分含量为90%.
14.用稀的碱性溶液或清水浸泡,可使残留在蔬菜上的农药降低毒性.如用碱性溶液浸泡蔬菜,可在水中加入适量的( )
| A. | 白酒 | B. | 纯碱 | C. | 白糖 | D. | 食醋 |
11.将a mol小苏打和b mol Na2O2置于某容积可变的密闭容器中充分加热,反应后测得容器内氧气为1mol,下列说法一定正确的是( )
| A. | b=2 | B. | 容器中一定没有残余的CO2和H2O | ||
| C. | 反应中转移的电子数一定为2NA | D. | a:b≥1 |
12.下列化学反应的离子方程式书写正确的是( )
| A. | 硫酸与Ba(OH)2溶液反应:H++OH-═H2O | |
| B. | 石灰石溶于盐酸中:CO32-+2H+═H2O+CO2↑ | |
| C. | 氯气与水反应:Cl2+H2O?2H++Cl-+ClO- | |
| D. | 氯化铝溶液与过量氨水反应:3NH3•H2O+Al3+═Al(OH)3↓+3NH4+ |
 :3-甲基-3-戊醇
:3-甲基-3-戊醇 :4-甲基-2-戊烯
:4-甲基-2-戊烯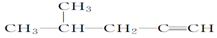 :4-甲基-1-戊炔
:4-甲基-1-戊炔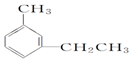 :1-甲基-3-乙苯(或间甲乙苯).
:1-甲基-3-乙苯(或间甲乙苯).