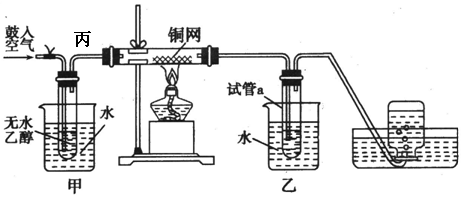
题目内容
3.常温下,下列各组离子在指定溶液中一定能大量共存的是( )| A. | 在水溶液中:H+、I-、NO3-、SiO32- | |
| B. | 饱和氯水中:Cl-、NO3-、Na+、SO3- | |
| C. | 将足量CO2通入时:H+、NH4+、Al3+、SO42- | |
| D. | 加入金属铝产生H2的溶液中:NH4+、Na+、SO42-、CH3COO- |
分析 A.离子之间发生氧化还原反应,结合生成沉淀;
B.饱和氯水具有强氧化性;
C.该组离子之间不反应;
D.加入金属铝产生H2的溶液,为非氧化性酸或强碱溶液.
解答 解:A.H+、I-、NO3-发生氧化还原反应,H+、SiO32-结合生成沉淀,不能共存,故A错误;
B.饱和氯水具有强氧化性,与SO3-发生氧化还原反应,不能共存,故B错误;
C.该组离子之间不反应,可大量共存,故C正确;
D.加入金属铝产生H2的溶液,为非氧化性酸或强碱溶液,酸溶液中不能大量存在CH3COO-,碱溶液中不能大量存在NH4+,故D错误;
故选C.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答该题的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.

练习册系列答案
相关题目
14.用稀的碱性溶液或清水浸泡,可使残留在蔬菜上的农药降低毒性.如用碱性溶液浸泡蔬菜,可在水中加入适量的( )
| A. | 白酒 | B. | 纯碱 | C. | 白糖 | D. | 食醋 |
11.将a mol小苏打和b mol Na2O2置于某容积可变的密闭容器中充分加热,反应后测得容器内氧气为1mol,下列说法一定正确的是( )
| A. | b=2 | B. | 容器中一定没有残余的CO2和H2O | ||
| C. | 反应中转移的电子数一定为2NA | D. | a:b≥1 |
18.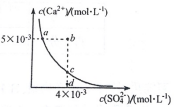 常温下,Ksp(CaSO4)=9 х 10?6,CaSO4 在水溶液中的沉淀溶解平衡曲线如图所示.下列说法不正确的是( )
常温下,Ksp(CaSO4)=9 х 10?6,CaSO4 在水溶液中的沉淀溶解平衡曲线如图所示.下列说法不正确的是( )
 常温下,Ksp(CaSO4)=9 х 10?6,CaSO4 在水溶液中的沉淀溶解平衡曲线如图所示.下列说法不正确的是( )
常温下,Ksp(CaSO4)=9 х 10?6,CaSO4 在水溶液中的沉淀溶解平衡曲线如图所示.下列说法不正确的是( )| A. | b 点可能有沉淀生成 | |
| B. | a 点对应的Ksp 等于c 点对应的Ksp | |
| C. | 在d 点溶液中加入一定量的CaCl2可能会有沉淀析出 | |
| D. | CaSO4 溶解在水中,一定有c(Ca2+)=c(SO42-)=3×10-3mol•L-1 |
15.NA代表阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.2×6.02×1023 | |
| B. | 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 0.1molNa2O2与足量二氧化碳充分反应转移的电子数为0.2NA | |
| D. | 0.1molFe在0.1mol氯气中燃烧,转移的电子数为0.2NA |
12.下列化学反应的离子方程式书写正确的是( )
| A. | 硫酸与Ba(OH)2溶液反应:H++OH-═H2O | |
| B. | 石灰石溶于盐酸中:CO32-+2H+═H2O+CO2↑ | |
| C. | 氯气与水反应:Cl2+H2O?2H++Cl-+ClO- | |
| D. | 氯化铝溶液与过量氨水反应:3NH3•H2O+Al3+═Al(OH)3↓+3NH4+ |
13.现有失去标签的四瓶无色溶液分别为Na2CO3溶液、稀盐酸、Ba(OH)2溶液、NaHSO4溶液,为确定四瓶溶液分别是什么,将其随意标号为A、B、C、D,分别取少量溶液两两混合,产生的现象如表所示.
已知:NaHSO4属于酸式盐,在水溶液中的电离方程式为:NaHSO4═Na++H++SO42-.
根据实验现象,回答下列问题:
(1)A为Na2CO3溶液,C为稀盐酸
(2)写出下列反应的离子方程式A+B:CO32-+Ba2+=BaCO3↓,A+D:CO32-+2H+=CO2↑+H2O,
(3)等物质的量浓度、等体积的B、D混合反应的离子方程式为Ba2++OH-+H++SO42-=BaSO4↓+H2O,反应后得到的溶液中含有的阴离子有OH-.
(4)上述没有明显变化的实验④、⑥,其中④发生了离子反应,离子方程式为H++OH-=H2O.
| 实验顺序 | 实验内容 | 实验现象 | 实验顺序 | 实验内容 | 实验现象 | |
| ① | A+B | 生成白色沉淀 | ④ | B+C | 无明显变化 | |
| ② | A+C | 放出无色气体 | ⑤ | B+D | 生成白色沉淀 | |
| ③ | A+D | 放出无色气体 | ⑥ | C+D | 无明显变化 |
根据实验现象,回答下列问题:
(1)A为Na2CO3溶液,C为稀盐酸
(2)写出下列反应的离子方程式A+B:CO32-+Ba2+=BaCO3↓,A+D:CO32-+2H+=CO2↑+H2O,
(3)等物质的量浓度、等体积的B、D混合反应的离子方程式为Ba2++OH-+H++SO42-=BaSO4↓+H2O,反应后得到的溶液中含有的阴离子有OH-.
(4)上述没有明显变化的实验④、⑥,其中④发生了离子反应,离子方程式为H++OH-=H2O.
 :3-甲基-3-戊醇
:3-甲基-3-戊醇 :4-甲基-2-戊烯
:4-甲基-2-戊烯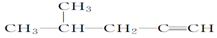 :4-甲基-1-戊炔
:4-甲基-1-戊炔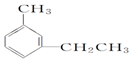 :1-甲基-3-乙苯(或间甲乙苯).
:1-甲基-3-乙苯(或间甲乙苯).