题目内容
7.(1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:①混合溶液中由水电离出的c(H+)>0.2mol/L的HCl溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):c(Cl-)-c(M+)=9.9×10-7 mol/L.
(2)常温下若将0.2mol/L HA溶液与0.1mol/L NaOH溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下HA的电离程度>NaA的水解程度.(填“>”、“<”、或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH<7.(填“>7”、“<7”、或“无法确定”)
(4)已知:温度和浓度相等时,氨水的电离程度与醋酸相等.常温下,下列4种溶液:
①0.1mol/L CH3COONa ②0.1mol/L CH3COONH4 ③0.1mol/L CH3COOH
④0.1mol/LCH3COONa和0.1mol/LNaOH的混合溶液
按pH由大到小顺序排列④①②③(填序号)
分析 (1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),混合后溶液中溶质为0.1mol/L的MCl,测得混合溶液的pH=6,说明MCl是强酸弱碱盐,则MOH是弱碱;
①酸或碱抑制水电离,含有弱离子的盐促进水电离;
②溶液中存在电荷守恒c(Cl-)-c(M+)=c(H+)-c(OH-),该溶液中c(H+)=10-6 mol/L,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-6}}$mol/L=10-8mol/L;
(2)常温下若将0.2mol/L HA溶液与0.1mol/L NaOH溶液等体积混合,混合溶液中的溶质为等物质的量浓度的HA和NaA,测得混合溶液的pH<7,说明HA的电离程度大于NaA水解程度;
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,说明HR不是强酸,应该是弱酸,酸的物质的量大于碱,混合溶液中溶质为酸和NaR,且酸的电离程度大于NaR水解程度;
(4)温度和浓度相等时,氨水的电离程度与醋酸相等,
①0.1mol/L CH3COONa,醋酸钠是强碱弱酸盐,其水溶液呈碱性;
②0.1mol/L CH3COONH4,醋酸根离子和铵根离子水解程度相同,则该溶液呈中性;
③0.1mol/L CH3COOH,醋酸是弱酸,部分电离,溶液呈酸性;
④0.1mol/LCH3COONa和0.1mol/LNaOH的混合溶液,NaOH是强碱溶液,混合溶液呈碱性,且碱性大于①
.
解答 解:(1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),混合后溶液中溶质为0.1mol/L的MCl,测得混合溶液的pH=6,说明MCl是强酸弱碱盐,则MOH是弱碱;
①酸或碱抑制水电离,含有弱离子的盐促进水电离,所以混合溶液促进水电离、HCl抑制水电离,则混合溶液中由水电离出的c(H+)>0.2mol/L的HCl溶液中由水电离出的c(H+),故答案为:>;
②溶液中存在电荷守恒c(Cl-)-c(M+)=c(H+)-c(OH-),该溶液中c(H+)=10-6 mol/L,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-6}}$mol/L=10-8mol/L,c(Cl-)-c(M+)=c(H+)-c(OH-)=10-6 mol/L-10-8mol/L=9.9×10-7mol/L,
故答案为:9.9×10-7 ;
(2)常温下若将0.2mol/L HA溶液与0.1mol/L NaOH溶液等体积混合,混合溶液中的溶质为等物质的量浓度的HA和NaA,测得混合溶液的pH<7,溶液呈酸性,说明HA的电离程度大于NaA水解程度,故答案为:>;
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,说明HR不是强酸,应该是弱酸,酸的物质的量大于碱,混合溶液中溶质为酸和NaR,且酸的电离程度大于NaR水解程度,所以混合溶液呈酸性,则pH<7,故答案为:<7;
(4)温度和浓度相等时,氨水的电离程度与醋酸相等,
①0.1mol/L CH3COONa,醋酸钠是强碱弱酸盐,其水溶液呈碱性;
②0.1mol/L CH3COONH4,醋酸根离子和铵根离子水解程度相同,则该溶液呈中性;
③0.1mol/L CH3COOH,醋酸是弱酸,部分电离,溶液呈酸性;
④0.1mol/LCH3COONa和0.1mol/LNaOH的混合溶液,NaOH是强碱溶液,混合溶液呈碱性,且碱性大于①
;
所以这几种溶液pH大小顺序是④①②③,故答案为:④①②③.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生分析判断能力,把握混合溶液中溶质及其性质是解本题关键,注意溶液中存在的守恒及其应用,题目难度不大.

| A. | C3H8 和 C3H6 | B. | C2H6 和 C3H6 | C. | C2H4 和 C4H8 | D. | CH4 和 C2H6 |
| A. | HCl | B. | KOH | C. | NaCl | D. | CuSO4 |
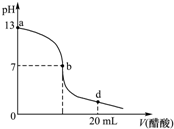 常温下,向20mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如下图所示,下列说法不正确的是( )
常温下,向20mL氢氧化钠溶液中逐滴加入0.2mol/L醋酸溶液,滴定曲线如下图所示,下列说法不正确的是( )| A. | 氢氧化钠溶液与醋酸溶液恰好完全反应的点位于曲线b、d间的某点 | |
| B. | 在b点,c(Na+)=c(CH3COO-) | |
| C. | 在d点,溶液中所有离子浓度由大到小的顺序为c(CH3COO-)>c (Na+)>c (H+)>c (OH-) | |
| D. | 该氢氧化钠溶液的物质的量浓度为0.1 mol/L |
| A. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O | |
| B. | 往碳酸镁中滴加稀盐酸:CO32-+2H+=CO2↑+H2O | |
| C. | 往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O | |
| D. | 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
 某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3的用量为25.0mL、大理石用量为10.00g.
某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3的用量为25.0mL、大理石用量为10.00g.请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探 究大理石规格(粗、细)对该反 应速率的影响;) |
| ② | ||||
| ③ | ||||
| ④ |
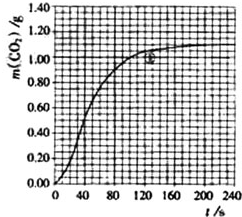
实验①在70-90s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)为由图可知70至90S,CO2生成的质量为m(CO2)=0.95g-0.84g=0.11g,物质的量为n(CO2)=0.0025mol,
由$\frac{1}{2}$CaCO3+HNO3═$\frac{1}{2}$Ca(NO3)2+$\frac{1}{2}$CO2↑+$\frac{1}{2}$H2O可知消耗HNO3的物质的量为n(HNO3)=0.0025mol×2=0.005mol,
又溶液体积为25ml=0.025L,所以HNO3减少的浓度△c(HNO3)=$\frac{△n}{V}$=$\frac{0.005mol}{0.025L}$=0.2mol•L-1,
反应时间为90s-70s=20s,所以HNO3在70-90S范围内的平均反应速率为v(HNO3)=$\frac{△c}{△t}$=$\frac{0.2mol•{L}^{-1}}{20s}$=0.01mol•L-1•S-1,
答:70-90s范围内HNO3的平均反应速率为0.01mol•L-1•S-1..
| A. | ⅠA元素的电负性从上到下逐渐减小,而ⅦA元素的电负性从上到下逐渐增大 | |
| B. | 最外层电子排布为ns2np6(若只有K层时为1s2)的原子,第一电离能较大 | |
| C. | 碳原子由1s22s22p2转化成1s22s12p3,这一过程中释放能量 | |
| D. | NaH的存在能支持可将氢元素放在ⅦA的观点 |
 某研究性学习小组进行原电池和电解的实验.
某研究性学习小组进行原电池和电解的实验.