题目内容
10.硝酸与金属反应时,浓度不同生成的还原产物也可能不同.某兴趣小组进行了如下实验探究.【查阅资料】
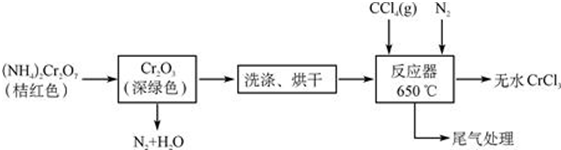
a.镁与硝酸反应生成各气体产物成分及含量随HNO3浓度变化曲线如图1所;
b.NO2沸点;21℃;NO沸点:-151℃
c.2NO2+2OH-═NO3-+NO2-+H2O,NO+NO2+2OH-═2NO2-+H2O.
(1)请写出Mg放入10mol/L硝酸中反应的化学方程式:Mg+4HNO3=Mg(NO3)2+2H2O+2NO2↑.
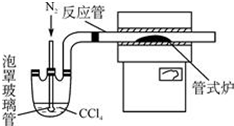
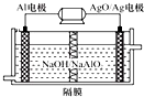
【实验探究】该小组拟选用如图2所示装置探究镁与4mol/L硝酸反应的产物.
连接装置A-B-C-D-C,检查气密性,按图示加入试剂,D中通入的O2微过量.
(2)a仪器的名称是分液漏斗.
(3)前一个C装置的作用是吸收未被冷却的二氧化氮,证明气体产物中有NO生成的实验现象是D装置中有红棕色气体出现.
(4)从后一个C装置中逸出的气体主要是氮气和氢气.
(5)实验中硝酸被镁还原的产物除了气体外,溶液中还可能有一种还原产物,这种还原产物可能是铵盐,请设计实验验证你的猜想在所得溶液中加入氢氧化钠溶液并微热,用湿润的红色石蕊试纸检验,如果红色石蕊试纸变蓝,则可证明的铵根离子产生.
分析 (1)根据图象可知,Mg放入10mol/L硝酸中产生二氧化氮,根据电子得失守恒和元素守恒书写化学方程式;
(2)根据装置图可知仪器a的名称为分液漏斗;
(3)前一个C装置是吸收未被冷却的二氧化氮,一氧化氮为无色气体,遇到空气中的氧气能被氧化成红棕色的二氧化氮;
(4)在D装置中一氧化氮被氧化成二氧化氮,二氧化氮被氢氧化钠吸收,氢气和氮气不能被吸收;
(5)硝酸被还成氮的氧化物都为气体,如果不是气体根据化合升降规则可知,应为铵盐,可以用氢氧化钠溶液及红色石饭蕊试纸检验;
解答 解:(1)根据图象可知,Mg放入10mol/L硝酸中产生二氧化氮,反应的化学方程式为Mg+4HNO3=Mg(NO3)2+2H2O+2NO2↑,
故答案为:Mg+4HNO3=Mg(NO3)2+2H2O+2NO2↑;
(2)根据装置图可知仪器a的名称为分液漏斗,
故答案为:分液漏斗;
(3)前一个C装置是吸收未被冷却的二氧化氮,防止其对后面一氧化氮的检验产生影响,一氧化氮为无色气体,遇到空气中的氧气能被氧化成红棕色的二氧化氮,所以看到D装置中有红棕色气体出现,则证明体产物中有NO生成,
故答案为:吸收未被冷却的二氧化氮;D装置中有红棕色气体出现;
(4)在D装置中一氧化氮被氧化成二氧化氮,二氧化氮被氢氧化钠吸收,氢气和氮气不能被吸收,所以从后一个C装置中逸出的气体主要是氮气和氢气,
故答案为:氮气和氢气;
(5)硝酸被还成氮的氧化物都为气体,如果不是气体根据化合升降规则可知,应为铵盐,可以在所得溶液中加入氢氧化钠溶液并微热,用湿润的红色石蕊试纸检验,如果红色石蕊试纸变蓝,则可证明的铵根离子产生,
故答案为:铵盐;在所得溶液中加入氢氧化钠溶液并微热,用湿润的红色石蕊试纸检验,如果红色石蕊试纸变蓝,则可证明的铵根离子产生.
点评 本题考查反应产物的测定、对实验原理与装置的理解、实验方案设计等,难度中等,理解实验原理是解题的关键,是对知识的综合考查,需要学生具有知识的基础与综合运用知识分析问题、解决问题的能力.

 名校课堂系列答案
名校课堂系列答案
| A. | 该电池放电时,正极的电极反应为O2+4H++4e-═2H2O | |
| B. | 该电池充电时,阴极发生了氧化反应:Li++e-═Li | |
| C. | 电池中的有机电解液可以用稀盐酸代替 | |
| D. | 正极区产生的LiOH可回收利用 |
| A. | 氢氧化钠溶于水只发生扩散作用 | |
| B. | 氢氧化钠溶于水只发生水合作用 | |
| C. | 氢氧化钠溶于水扩散过程吸收热量大于水合过程放出的热量 | |
| D. | 氢氧化钠溶于水扩散过程吸收热量小于水合过程放出的热量 |
| A. | 3:7 | B. | 3:4 | C. | 4:7 | D. | 1:3 |
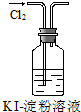
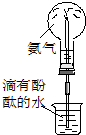
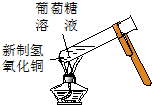
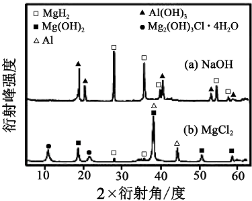
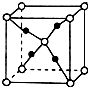 X、Y、Z、R是元素周期表中前四周期中的常见元素.X的单质是密度最小的气体;Y的一种核素常用于考古,且其一种同素异形体是较软的物质之一;Z的气态氢化物与其最高价氧化物的水化物相遇会产生大量白烟;R2+离子的3d轨道有9个电子.(答题时用具体的元素符号)
X、Y、Z、R是元素周期表中前四周期中的常见元素.X的单质是密度最小的气体;Y的一种核素常用于考古,且其一种同素异形体是较软的物质之一;Z的气态氢化物与其最高价氧化物的水化物相遇会产生大量白烟;R2+离子的3d轨道有9个电子.(答题时用具体的元素符号)
 ;A→F
;A→F