题目内容
有短周期主族元素A、B、C、D,A、D同主族,最外层电子数都为1:;B、C同周期,C原子最外层电子数比B原子少2个,且最外层电子数是次外层电子数的2倍.A、B单质在常温下均为气体.它们在一定条件下以体积2:1完全反应,生成物在常温下是液体.此液体与D单质能剧烈反应生成A单质,所得溶液中含有与氖原子电子层结构相同的阳离子.
回答下列问题:
(1)写出元素符号:A. B. C. D.
(2)B单质与D单质加热反应后生成的化学式为
(3)由A、B、C、D、共同组成的化合物的化学式是 .
回答下列问题:
(1)写出元素符号:A.
(2)B单质与D单质加热反应后生成的化学式为
(3)由A、B、C、D、共同组成的化合物的化学式是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:短周期主族元素A、B、C、D,C原子最外层电子数比B原子少2个,且最外层电子数是次外层电子数的2倍,C原子只能有2个电子层,最外层电子数为4,则C为碳元素;B原子最外层电子数为6,B、C在同一周期,则B为O元素;A、D同主族,A、D原子的最外层电子数都是1,处于ⅠA族,D的原子序数大于O,故D为Na,A的单质为气体,则A为H元素;氢气与氧气生成水,钠与水反应生成氢氧化钠与氢气,钠离子与氖原子的电子层结构相同,符合题意,据此解答.
解答:
解:短周期主族元素A、B、C、D,C原子最外层电子数比B原子少2个,且最外层电子数是次外层电子数的2倍,C原子只能有2个电子层,最外层电子数为4,则C为碳元素;B原子最外层电子数为6,B、C在同一周期,则B为O元素;A、D同主族,A、D原子的最外层电子数都是1,处于ⅠA族,D的原子序数大于O,故D为Na,A的单质为气体,则A为H元素;氢气与氧气生成水,钠与水反应生成氢氧化钠与氢气,钠离子与氖原子的电子层结构相同,符合题意,
(1)由上述分析可知,A、B、C、D的元素符号分别是H、O、C、Na,故答案为:H、O、C、Na;
(2)Na和O2加热反应生成Na2O2,故答案为:Na2O2;
(3)由H、O、C、Na组成的化合物为NaHCO3等,故答案为:NaHCO3等.
(1)由上述分析可知,A、B、C、D的元素符号分别是H、O、C、Na,故答案为:H、O、C、Na;
(2)Na和O2加热反应生成Na2O2,故答案为:Na2O2;
(3)由H、O、C、Na组成的化合物为NaHCO3等,故答案为:NaHCO3等.
点评:本题考查结构性质位置关系应用,推断元素是解题关键,侧重对基础知识的考查,难度不大.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
在一定温度下,定容密闭容器中发生反应:H2(g)+I2(g)?2HI(g),下列能说明反应已达平衡状态的是( )
| A、容器内气体压强不再变化 |
| B、混合气体的密度恒定不变 |
| C、混合气体的颜色不再变化 |
| D、v正(H2)=v逆(HI) |
有BaCl2和NaCl的混合溶液a L,将它均分成两份.一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀.反应中消耗x mol H2SO4、y mol AgNO3.据此得知原混合溶液中的c(Na+)/mol?L-1为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
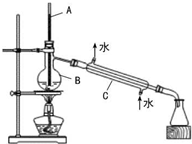 现有一瓶乙二醇和丙三醇的混合物,它们有如下性质,使用右图装置进行分离,下列说法正确的是( )
现有一瓶乙二醇和丙三醇的混合物,它们有如下性质,使用右图装置进行分离,下列说法正确的是( )| 物质 | 沸点/℃ | 溶解性 |
| 乙二醇 | 198 | 易溶于水和乙醇 |
| 丙三醇 | 290 | 能跟水、乙醇任意比互溶 |
| A、在正确操作情况下,锥形瓶中收集到的物质为乙二醇 |
| B、仪器C中进出水口方向错误 |
| C、仪器A为玻璃棒,所处位置错误 |
| D、仪器B的名称为圆底烧瓶. |


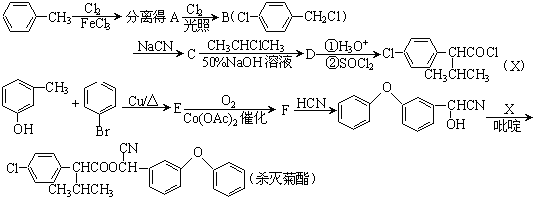
 (1)用50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1NaOH溶液在如图1所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
(1)用50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1NaOH溶液在如图1所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题: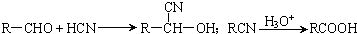 .
.
 (1)已知24克A和40克B恰好完全反应生成0.4molC和32克D,则C的摩尔质量为
(1)已知24克A和40克B恰好完全反应生成0.4molC和32克D,则C的摩尔质量为