题目内容
有BaCl2和NaCl的混合溶液a L,将它均分成两份.一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀.反应中消耗x mol H2SO4、y mol AgNO3.据此得知原混合溶液中的c(Na+)/mol?L-1为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
考点:物质的量浓度的相关计算
专题:
分析:第一份溶液中发生的反应为BaCl2+H2SO4=BaSO4↓+2HCl,根据n(H2SO4)计算n(BaCl2);第二份溶液中发生的反应为BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2、NaCl+AgNO3=AgCl↓+NaNO3,根据n(BaCl2)计算和BaCl2反应的n(AgNO3),剩余AgNO3和NaCl反应生成AgCl,据此计算NaCl物质的量,再结合C=
计算c(Na+);
| n |
| V |
解答:
解:第一份溶液中发生的反应为BaCl2+H2SO4=BaSO4↓+2HCl,根据BaCl2~H2SO4知,n(H2SO4)=n(BaCl2)=xmol;
第二份溶液中发生的反应为BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2、NaCl+AgNO3=AgCl↓+NaNO3,根据BaCl2~2AgNO3知,和BaCl2反应的n(AgNO3)=2n(BaCl2)=2xmol,
则剩余AgNO3和NaCl反应生成AgCl,根据NaCl~AgNO3知,和NaCl反应的硝酸银物质的量n(AgNO3)=n(NaCl)=ymol-2xmol,则两种溶液中NaCl的总物质的量为2ymol-4xmol,根据Na原子守恒知,n(Na+)=n(NaCl)=2ymol-4xmol,则原来混合溶液中c(Na+)=
=
mol/L,
故选A.
第二份溶液中发生的反应为BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2、NaCl+AgNO3=AgCl↓+NaNO3,根据BaCl2~2AgNO3知,和BaCl2反应的n(AgNO3)=2n(BaCl2)=2xmol,
则剩余AgNO3和NaCl反应生成AgCl,根据NaCl~AgNO3知,和NaCl反应的硝酸银物质的量n(AgNO3)=n(NaCl)=ymol-2xmol,则两种溶液中NaCl的总物质的量为2ymol-4xmol,根据Na原子守恒知,n(Na+)=n(NaCl)=2ymol-4xmol,则原来混合溶液中c(Na+)=
| 2ymol-4xmol |
| aL |
| 2y-4x |
| a |
故选A.
点评:本题考查离子方程式计算,明确物质之间的反应是解本题关键,侧重考查学生分析问题、计算能力,注意溶液体积大小判断,为易错题,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列有关化学键的叙述,正确的是( )
| A、离子化合物中不一定含有离子键 |
| B、单质分子中均不存在化学键 |
| C、由C元素形成的单质不一定是原子晶体 |
| D、含有共价键的化合物一定是共价化合物 |
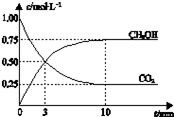 已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.一定条件下,向体积为 1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.一定条件下,向体积为 1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )| A、升高温度能使CH3OH增加 |
| B、反应达到平衡状态时,CO2的平衡转化率为75% |
| C、3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 |
| D、从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol?L-1?min-1 |
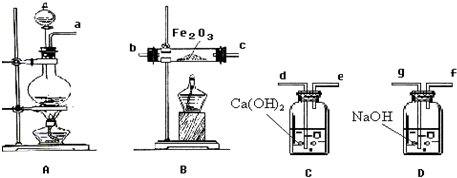

 为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.
 掌握仪器的名称,组装及使用方法是中学化学实验的基础,如图为两套实验装置.
掌握仪器的名称,组装及使用方法是中学化学实验的基础,如图为两套实验装置.