题目内容
2.扁桃酸衍生物是重要的医药中间体,在合成该有机物的过程中涉及如图转化:
下列说法正确的是( )
| A. | 化合物X的分子式为C8H8O4 | |
| B. | 化合物X、Y均可与NaHCO3溶液反应生成CO2 | |
| C. | 化合物X、Y分子中均含有1个手性碳原子 | |
| D. | 在一定条件下,化合物Y可发生加成反应和消去反应 |
分析 A.由结构简式元素种类和原子个数,可确定分子式;
B.Y不含羧基,与碳酸氢钠溶液不反应;
C.支链中与苯环相连的C为手性碳原子;
D.Y不能发生消去反应.
解答 解:A.由结构简式可知X的分子式为C8H8O4,故A正确;
B.Y含有酚羟基,不含羧基,酸性比碳酸弱,则与碳酸氢钠溶液不反应,故B错误;
C.连接四个不同的原子或原子团的为手性碳原子,则支链中与苯环相连的C为手性碳原子,故C正确;
D.Y中Br邻位碳原子不含氢原子,则不能发生消去反应,故D错误.
故选AC.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的结构和官能团的性质,难度不大.

练习册系列答案
相关题目
14.下列说法正确的是( )
| A. | 第3层最多能容纳32个电子 | |
| B. | 磷原子的结构示意图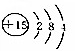 | |
| C. | 第2周期元素的最高正价从+1递增到+7 | |
| D. | 同周期主族元素的原子半径随原子序数的递增而逐渐减小 |
15.下列关于有机物M( )的说法不正确的是( )
)的说法不正确的是( )
 )的说法不正确的是( )
)的说法不正确的是( )| A. | 分子式为C15H14O4 | |
| B. | 苯环上的一氯代物有7种 | |
| C. | 能发生氧化反应和取代反应 | |
| D. | 1mol M与足量的Na反应,最多消耗3mol Na |
11.短周期主族元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是其电子层数的2倍,X、Y的核电荷数之比为3:4,W原子的最外层比次外层少1个电子,Z原子最外层只有1个电子.下列说法正确的是( )
| A. | X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应 | |
| B. | 原子半径大小关系:X>Y,Z<W | |
| C. | 化合物Z2Y和ZWY都只存在离子键 | |
| D. | Y、W的某些单质或两元素之间形成的某些化合物可作水的消毒剂 |
17.X、Y、Z、W均为短周期主族元素,原子序数依次递增.X与Z位于同一主族,Z的核外电子数是X的2倍,Y、Z、W原子的最外层电子数之和等于Z的核外电子总数.下列说法正确的是( )
| A. | 原子半径由小到大的顺序:X<Y<Z<W | |
| B. | Z的最高价氧化物对应的水化物为弱酸 | |
| C. | 在一定条件下,与Y同主族的短周期元素某单质可以与氧化铁发生置换反应 | |
| D. | 常温下,0.1mol•L-1 W的氢化物水溶液的pH>1 |
6.实验室以苯甲酸和乙醇为原料制备甲酸乙酯(实验装置如图所示,相关物质的沸点如表).其实验步骤如表:
步骤1:将三颈瓶中的苯甲酸、乙醇、浓硫酸和环己烷按一定配比充分混合后,升温至60℃.
步骤2:将反应混合物倒入分液漏斗中,静置、分液.
步骤3:向上层液体中加入乙醚,再向混合液中加入饱和碳酸钠溶液,分离出乙醚层.
步骤4:向乙醚层中加入固体氯化钙后进行蒸馏,收集相应馏分.
(1)反应容器中制取苯甲酸乙酯的化学方程式为 +CH3CH2OH$?_{60℃}^{浓H_{2}SO_{4}}$
+CH3CH2OH$?_{60℃}^{浓H_{2}SO_{4}}$ +H2O;实验装置中冷凝管的主要作用是冷凝回流.
+H2O;实验装置中冷凝管的主要作用是冷凝回流.
(2)向反应体系中加入环己烷,可以提高产物效率的原因是与反应物形成共沸溶液,有利于将生成的水带走,使化学平衡向右移动.
(3)步骤4中加入固体氯化钙的作用是吸收水分.
(4)向反应体系中加入苯也可以制取苯甲酸乙酯,用环己烷代替苯的优点是减少有毒试剂的使用.
(5)步骤3中加入乙醚和饱和碳酸钠溶液的作用是萃取.
| 物质 | 苯甲酸 | 乙醇 | 环己烷 | 浓硫酸 | 苯甲酸乙酯 |
| 沸点/℃ | 249 | 78.3 | 80.7 | 338 | 212.6 |
步骤2:将反应混合物倒入分液漏斗中,静置、分液.
步骤3:向上层液体中加入乙醚,再向混合液中加入饱和碳酸钠溶液,分离出乙醚层.
步骤4:向乙醚层中加入固体氯化钙后进行蒸馏,收集相应馏分.
(1)反应容器中制取苯甲酸乙酯的化学方程式为
 +CH3CH2OH$?_{60℃}^{浓H_{2}SO_{4}}$
+CH3CH2OH$?_{60℃}^{浓H_{2}SO_{4}}$ +H2O;实验装置中冷凝管的主要作用是冷凝回流.
+H2O;实验装置中冷凝管的主要作用是冷凝回流.(2)向反应体系中加入环己烷,可以提高产物效率的原因是与反应物形成共沸溶液,有利于将生成的水带走,使化学平衡向右移动.
(3)步骤4中加入固体氯化钙的作用是吸收水分.
(4)向反应体系中加入苯也可以制取苯甲酸乙酯,用环己烷代替苯的优点是减少有毒试剂的使用.
(5)步骤3中加入乙醚和饱和碳酸钠溶液的作用是萃取.
13.下列实验方案中,能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 配制100mL1.0mol/LCuSO4溶液 | 将25g CuSO4•5H2O溶于100mL蒸馏水中 |
| B | 除去CuO中混有的Al2O3 | 加入过量NaOH溶液后,过滤、洗涤、干燥 |
| C | 证明氧化性:H2O2>Fe3+ | 强硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
| D | 证明非金属性:Cl>C | 向NaHCO3溶液中加入过量盐酸振荡、静置、观察 |
| A. | A | B. | B | C. | C | D. | D |
10. 某手机电池采用了石墨烯电池,可充电5分钟,通话2小时.一种石墨烯锂硫电池(2Li+S8=Li2S8)工作原理示意图如图.已知参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量.下列有关该电池说法不正确的是( )
某手机电池采用了石墨烯电池,可充电5分钟,通话2小时.一种石墨烯锂硫电池(2Li+S8=Li2S8)工作原理示意图如图.已知参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量.下列有关该电池说法不正确的是( )
 某手机电池采用了石墨烯电池,可充电5分钟,通话2小时.一种石墨烯锂硫电池(2Li+S8=Li2S8)工作原理示意图如图.已知参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量.下列有关该电池说法不正确的是( )
某手机电池采用了石墨烯电池,可充电5分钟,通话2小时.一种石墨烯锂硫电池(2Li+S8=Li2S8)工作原理示意图如图.已知参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量.下列有关该电池说法不正确的是( )| A. | 金属锂是所有金属中比能量最高的电极材料 | |
| B. | A电极为该电源的负极,发生氧化反应 | |
| C. | B电极的反应:2Li++S8+2e-═Li2S8 | |
| D. | 电子从A电极经过外电路流向B电极,再经过电解质流回A电极 |
11.甲、乙、丙、丁四种物质在一定条件下有如图所示的转化关系.下列判断正确的是( )

| A. | 若图中均为非氧化还原反应,当丁为一元强碱时,甲可能是NaAlO2 | |
| B. | 若图中均为非氧化还原反应,当丁为一元强酸时,甲可能是NaOH | |
| C. | 若图中均为氧化还原反应,当丁为非金属单质时,丙可能是NH3 | |
| D. | 若图中均为氧化还原反应,当丁为金属单质时,丙可能是FeCl3 |