题目内容
11.短周期主族元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是其电子层数的2倍,X、Y的核电荷数之比为3:4,W原子的最外层比次外层少1个电子,Z原子最外层只有1个电子.下列说法正确的是( )| A. | X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应 | |
| B. | 原子半径大小关系:X>Y,Z<W | |
| C. | 化合物Z2Y和ZWY都只存在离子键 | |
| D. | Y、W的某些单质或两元素之间形成的某些化合物可作水的消毒剂 |
分析 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是其电子层数的2倍,则X为C元素;X、Y的核电荷数之比为3:4,Y为O元素;W原子的最外层比次外层少1个电子,则W为Cl元素;Z原子最外层只有1个电子,可知Z为第三周期的Na元素,以此来解答.
解答 解:由上述分析可知,X为C,Y为O,Z为Na,W为Cl,
A.只有二氧化碳与NaOH反应,CO不能,故A错误;
B.电子层越多,原子半径越大,同周期从左向右原子半径减小,则原子半径大小关系:Z>W>X>Y,故B错误;
C.化合物Na2O只含离子键,NaClO含离子键、共价键,故C错误;
D.臭氧、氯气、二氧化氯均可作水的消毒剂,故D正确;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、电子排布推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.已知25℃时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,MgF2的溶度积常数Ksp=7.4×10-11.下列说法正确的是( )
| A. | 25℃时,向饱和MgF2溶液中加入饱和NaOH溶液后,不可能有Mg(OH)2生成 | |
| B. | 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者c(Mg2+)大 | |
| C. | 25℃时,Mg(OH)2固体在同体积同浓度的氨水和NH4Cl溶液中的Ksp相比较,前者小 | |
| D. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
3. 有X、Y、Z单质X一种短周期元素,原子半径由大到小的顺序为Y>X>Z,原子序数之和为16,三种元素的常见单质在适当条件下可发生如图所示的变化,其中B和C均为10电子分子,下列有关判断不正确的是( )
有X、Y、Z单质X一种短周期元素,原子半径由大到小的顺序为Y>X>Z,原子序数之和为16,三种元素的常见单质在适当条件下可发生如图所示的变化,其中B和C均为10电子分子,下列有关判断不正确的是( )
 有X、Y、Z单质X一种短周期元素,原子半径由大到小的顺序为Y>X>Z,原子序数之和为16,三种元素的常见单质在适当条件下可发生如图所示的变化,其中B和C均为10电子分子,下列有关判断不正确的是( )
有X、Y、Z单质X一种短周期元素,原子半径由大到小的顺序为Y>X>Z,原子序数之和为16,三种元素的常见单质在适当条件下可发生如图所示的变化,其中B和C均为10电子分子,下列有关判断不正确的是( )| A. | X的气态氢化物的热稳定性比Y的强 | |
| B. | Y的气态氢化物通入其最高价氧化物对应的水化物溶液中,得到的溶液一定呈酸性 | |
| C. | A与C能发生氧化还原反应 | |
| D. | Y元素位于第二周期ⅤA族 |
20.T℃时,向10L容积不变的密闭容器中加入1.0mol NH2COONH4,发生反应NH2COONH4(s)?CO2(g)+2NH3(g)△H>0,5min达到平衡,测得容器中NH2COONH4(s)的物质的量为0.2mol,下列说法正确的是( )
| A. | 0~5min内,v(CO2)=0.16mol•L-1•min-1 | |
| B. | 氨气体积分数不变时,该反应一定达到平衡状态 | |
| C. | 平衡后,缩小容器容积,重新建立平衡时,c(CO2)增大 | |
| D. | 其他条件不变,若将原容器改为绝热容器,则达到平衡时,NH2COONH4的转化率小于80% |
7.分子式为C6H12O2且能与小苏打溶液反应放出气体的有机物共有几种(不考虑立体异构)( )
| A. | 4 | B. | 6 | C. | 8 | D. | 10 |
15.下列有关化学用语表示正确的是( )
| A. | 核内有8个中子的碳原子:${\;}_{6}^{8}$C | B. | 硫离子的结构示意图: | ||
| C. | NH4Cl的电子式: | D. | 苯甲酸乙酯的结构简式: |
2.扁桃酸衍生物是重要的医药中间体,在合成该有机物的过程中涉及如图转化:

下列说法正确的是( )

下列说法正确的是( )
| A. | 化合物X的分子式为C8H8O4 | |
| B. | 化合物X、Y均可与NaHCO3溶液反应生成CO2 | |
| C. | 化合物X、Y分子中均含有1个手性碳原子 | |
| D. | 在一定条件下,化合物Y可发生加成反应和消去反应 |
18.下列物质属于电解质的是( )
| A. | CO2 | B. | Ca(OH)2 | C. | 食盐水 | D. | 石墨 |
19.下列实验不能达到实验目的或者实验操作不正确的是( )
| A. | 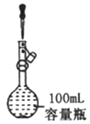 定容 | |
| B. | 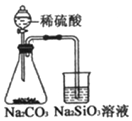 比较硫、碳、硅三种元素的非金属性强弱 | |
| C. | 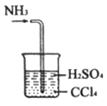 处理尾气 | |
| D. | 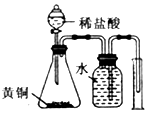 测定黄铜(Cu、Zn合金)中Zn的含量 |