题目内容
14.下列说法正确的是( )| A. | 第3层最多能容纳32个电子 | |
| B. | 磷原子的结构示意图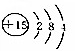 | |
| C. | 第2周期元素的最高正价从+1递增到+7 | |
| D. | 同周期主族元素的原子半径随原子序数的递增而逐渐减小 |
分析 A.每层最多容纳2n2个电子;
B.P原子核外15个电子,分三层排布,最外层5个电子;
C.第2周期元素从左到右,最高正价增大,但O、F没有正价;
D.电子层相同时,原子序数越大,原子半径越小.
解答 解:A.每层最多容纳2n2个电子,所以第3层最多能容纳18个电子,故A错误;
B.P原子核外15个电子,分三层排布,最外层5个电子,则磷原子的结构示意图 ,故B错误;
,故B错误;
C.第2周期元素从左到右,最高正价增大,但O、F没有正价,所以第2周期元素的最高正价从+1递增到+5,故C错误;
D.电子层相同时,原子序数越大,原子半径越小,则同周期主族元素的原子半径随原子序数的递增而逐渐减小,故D正确.
故选D.
点评 本题考查周期表的结构及应用,为高频考点,涉及电子排布、原子结构示意图、元素周期律、原子半径比较等,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
2.已知25℃时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,MgF2的溶度积常数Ksp=7.4×10-11.下列说法正确的是( )
| A. | 25℃时,向饱和MgF2溶液中加入饱和NaOH溶液后,不可能有Mg(OH)2生成 | |
| B. | 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者c(Mg2+)大 | |
| C. | 25℃时,Mg(OH)2固体在同体积同浓度的氨水和NH4Cl溶液中的Ksp相比较,前者小 | |
| D. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
9.下列说法或化学用语表达正确的是( )
| A. | s能级的原子轨道呈球形,处在该轨道上的电子只能在球壳内运动 | |
| B. | p能级的原子轨道呈纺锤形,随着能层的增加,p能级原子轨道也在增多 | |
| C. | 某原子的电子排布式为1s22s2 2p63s2 3p63d54s1属于激发态 | |
| D. | Fe2+的电子排布式为1s22s2 2p63s2 3p63d6 |
19.下列化合物中,同分异构体数目最少的是( )
| A. | 戊烷 | B. | 苯酚 | C. | 1-氯己烷 | D. | 乙酸乙酯 |
6.下列实验的操作、现象和解释或结论都正确的是( )
| 操作 | 现象 | 解释或结论 | |
| A | 将饱和Na2SO4溶液加入到饱和石灰水 | 有白色沉淀 | 有Na2SO4晶体析出 |
| B |  | 试剂瓶中有一段稳定水柱 | 装置气密性良好 |
| C | 将Al2(SO4)3溶液蒸干 | 有白色固体生成 | A13+水解生成Al(OH)3 |
| D |  | 锥形瓶溶液产生淡黄色沉淀 | 苯与溴发生取代反应 |
| A. | A | B. | B | C. | C | D. | D |
3. 有X、Y、Z单质X一种短周期元素,原子半径由大到小的顺序为Y>X>Z,原子序数之和为16,三种元素的常见单质在适当条件下可发生如图所示的变化,其中B和C均为10电子分子,下列有关判断不正确的是( )
有X、Y、Z单质X一种短周期元素,原子半径由大到小的顺序为Y>X>Z,原子序数之和为16,三种元素的常见单质在适当条件下可发生如图所示的变化,其中B和C均为10电子分子,下列有关判断不正确的是( )
 有X、Y、Z单质X一种短周期元素,原子半径由大到小的顺序为Y>X>Z,原子序数之和为16,三种元素的常见单质在适当条件下可发生如图所示的变化,其中B和C均为10电子分子,下列有关判断不正确的是( )
有X、Y、Z单质X一种短周期元素,原子半径由大到小的顺序为Y>X>Z,原子序数之和为16,三种元素的常见单质在适当条件下可发生如图所示的变化,其中B和C均为10电子分子,下列有关判断不正确的是( )| A. | X的气态氢化物的热稳定性比Y的强 | |
| B. | Y的气态氢化物通入其最高价氧化物对应的水化物溶液中,得到的溶液一定呈酸性 | |
| C. | A与C能发生氧化还原反应 | |
| D. | Y元素位于第二周期ⅤA族 |
2.扁桃酸衍生物是重要的医药中间体,在合成该有机物的过程中涉及如图转化:

下列说法正确的是( )

下列说法正确的是( )
| A. | 化合物X的分子式为C8H8O4 | |
| B. | 化合物X、Y均可与NaHCO3溶液反应生成CO2 | |
| C. | 化合物X、Y分子中均含有1个手性碳原子 | |
| D. | 在一定条件下,化合物Y可发生加成反应和消去反应 |