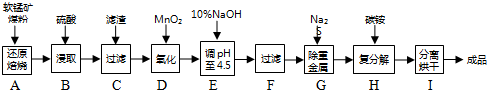
题目内容
19.(1)等质量的O2和O3所含分子的物质的量之比为3:2.(2)等温等压下,等体积的O2和O3所含分子个数比为1:1,
(3)在反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,氧化剂是KMnO4,氧化产物是Cl2,氧化产物与还原产物的物质的量之比为5:2,被氧化与未被氧化的HCl的质量之比为5:3,若有73g HCl被氧化,电子转移的总数为2NA.
(4)配制100mL 1mol•L-1的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84g•mL-1,质量分数为98%)的体积为5.4mL.
分析 (1)根据N=$\frac{m}{M}$×NA进行计算;
(2)等温等压下,气体摩尔体积相等,相同体积的氧气和臭氧其物质的量相等,根据N=nNA计算;
(3)2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价降低,Cl元素的化合价升高,结合方程式计算电子转移;
(4)先计算浓硫酸的物质的量浓度,再根据溶液稀释前后溶质的物质的量不变计算所需浓盐酸的体积.
解答 解:(1)根据N=$\frac{m}{M}$×NA知,相同质量时其分子数与摩尔质量成反比,所以二者分子数之比=48g/mol:32g/mol=3:2,
故答案为:3:2;
(2)等温等压下,气体摩尔体积相等,相同体积的氧气和臭氧其物质的量相等,根据N=nNA知,分子数之比等于物质的量之比=1:1,
故答案为:1:1;
(3)2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价降低,则氧化剂为KMnO4,Cl元素的化合价升高,Cl2为氧化产物,氧化产物与还原产物的物质的量之比为5:2;被氧化与未被氧化的HCl的质量之比为5:3;若有73g HCl被氧化,即2molHCl被氧化转移2mol电子,则电子转移的总数为2NA;
故答案为:KMnO4;Cl2;5:2;5:3;2NA;
(4)浓硫酸的物质的量浓度为$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要浓硫酸的体积为V,根据溶液稀释前后溶质的物质的量不变得:0.2mol/L×0.5L=18.4mol/L×V,V=0.0054L=5.4mL,
故答案为:5.4.
点评 本题考查物质的量有关计算和氧化还原反应,侧重考查学生计算能力和分析能力,明确各个物理量之间关系是解本题关键,题目难度不大.

| A. | CO和SO2 | B. | 甲醛和苯等有机物 | ||
| C. | SO2和NO2 | D. | O3和Cl2 |
| A. | Cl2 | B. | Na2O | C. | CO2 | D. | NH3 |
| A. | 常温下$\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中:NH4+、Al3+、NO3-、CO32- | |
| B. | 滴加石蕊试剂显红色的溶液中:Na+、Fe2+、Cl-、NO3- | |
| C. | 常温下由水电离出来的c(H+)=1×10-13mol•L-1的溶液中:K+、CO32-、Cl-、NO3- | |
| D. | 常温下,$\frac{{K}_{W}}{c({H}^{+})}$=0.1 mol•L-1的溶液:Na+、K+、CO32-、NO3- |
| A. | 在反应①中,生成3mol汞,转移3mol电子 | |
| B. | 在反应②中,硫化汞既是氧化产物,又是还原产物 | |
| C. | 在反应③中,产生11.2L氧气,转移2mol电子 | |
| D. | 由反应③知,汞在空气中加强热会生成氧化汞 |
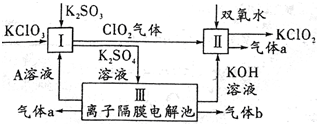 氯酸钾(KC1O3)和亚氯酸钾(KClO2)可以相互转化,KClO2在碱性环境中能稳定存在,生产KClO2的主要流程如图所示.
氯酸钾(KC1O3)和亚氯酸钾(KClO2)可以相互转化,KClO2在碱性环境中能稳定存在,生产KClO2的主要流程如图所示.