题目内容
10.为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体(FeSO4•7H2O)和胆矾晶体.
请回答:
(1)写出步骤Ⅰ反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)试剂X是稀硫酸或H2SO4.步骤 II、Ⅲ中均需进行的实验操作是过滤.
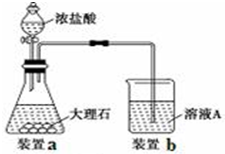
(3)进行步骤Ⅱ时,该小组用如图所示装置及试剂制取CO2并将制得的气体通入溶液A中.一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少.为了避免固体C减少,可采取的改进措施是在装置I和Ⅱ之间增加一个盛有饱和碳酸氢钠溶液的洗气瓶.
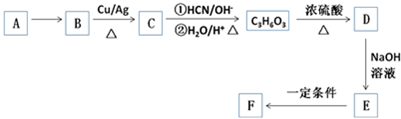
(4)用固体F制备CuSO4溶液,可设计以下三种途径:

写出途径①中反应的离子方程式3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,请选出你认为的最佳途径②说明选择的理由原料利用率高,环境污染小.
分析 金属铁和金属铜不与氢氧化钠反应,铝可与氢氧化钠反应,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO4•7H2O)和胆矾晶体流程为:合金中铝、氧化铝与氢氧化钠反应,所得滤液A为NaAlO2溶液,经途径Ⅱ与足量二氧化碳发生AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,反应可生成氢氧化铝固体C,生成的氢氧化铝再和盐酸反应生成AlCl3,得到的AlCl3较纯净;溶液D为碳酸氢钠溶液;
滤渣B为Fe和Cu的化合物,加入足量稀硫酸,得到的滤液E为FeSO4,经蒸发浓缩、冷却结晶可得到绿矾,滤渣F为Cu,可用于制备胆矾,
(1)铝、铁和铜的合金中,只有金属铝是能溶于氢氧化钠的固体物质;
(2)根据步骤Ⅰ加过量的氢氧化钠发生的反应以及金属铜和金属铁性质的区别之处进行解答;
(3)制得的CO2气体中混有氯化氢气体,用饱和的碳酸氢钠除去;
(4)金属铜可以和硝酸之间反应生成硝酸铜、一氧化氮和水,但是一氧化氮是有毒的,根据铜、稀硫酸的性质来判断反应的发生.
解答 解:铝、铁和铜的合金中只有金属铝可以和氢氧化钠之间反应生成溶液A偏铝酸钠,固体B是金属铁和金属铜,A中通入过量的二氧化碳可以得到氢氧化铝沉淀C和碳酸氢钠溶液D,金属铁可以和硫酸之间发生反应生成硫酸亚铁和氢气,但是金属铜和稀硫酸之间不反应,硫酸亚铁溶液蒸发浓缩、冷却结晶可以获得绿矾晶体,金属铜可以获得胆矾晶体.
(1)步骤Ⅰ加过量的氢氧化钠,金属铝和氢氧化钠反应,金属铝溶解其中生成偏铝酸钠溶液,即2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)金属铁和金属铜不与氢氧化钠反应,金属铜和稀硫酸之间不反应,但是金属铁可以和稀硫酸之间反应生成硫酸亚铁和氢气,进而制的绿矾晶体,步骤Ⅰ、Ⅱ、Ⅲ均是固体和液体的分离操作,应该是过滤,故答案为:稀硫酸或H2SO4;过滤;
(3)进行步骤Ⅱ时,该小组用如图2所示装置及试剂将制得的CO2气体通入溶液A中.一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是二氧化碳气体中含有从盐酸中挥发出的氯化氢气体,氯化氢在水中溶解了部分沉淀氢氧化铝,发生的反应为Al(OH)3+3H+=Al3++3H2O,为了避免固体C减少,可在制取二氧化碳的收集装置中增加一个洗去氯化氢的装置,二氧化碳在饱和碳酸氢钠中不溶,氯化氢和碳酸氢钠反应生成二氧化碳气体,所以可在装置I和Ⅱ之间增加一个盛有饱和碳酸氢钠溶液的洗气瓶,除去二氧化碳中的氯化氢,
故答案为:在装置I和Ⅱ之间增加一个盛有饱和碳酸氢钠溶液的洗气瓶;
(4)金属铜可以和硝酸之间反应生成硝酸铜、一氧化氮和水,即3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,铜不能和稀硫酸反应,但是当加热并通入空气之后,铜和氧气反应生成氧化铜,然后氧化铜会和硫酸反应生成硫酸铜,不会产生污染大气的气体,该过程原料利用率高,所以途径②最佳,
故答案为:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O;②;原料利用率高,环境污染小.
点评 本题是对物质的分离和提纯知识点的考查,注意掌握铝、铁和铜及其化合物的性质是解答本题的关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | $\frac{14M}{{a}^{3}{N}_{A}}$ | B. | $\frac{M}{{a}^{3}{N}_{A}}$ | C. | $\frac{2M}{{a}^{3}{N}_{A}}$ | D. | $\frac{4M}{{a}^{3}{N}_{A}}$ |
| No | 项目 | 结果 | 正常范围参考值 | 单位 |
| 1 | 红细胞计数 | 2.3 | 3.5~5 | 1×10 12/L |
| 2 | 血红蛋白 | 75 | 110~150 | g/L |
| 3 | 血小板计数 | 205.5 | 100~300 | 109/L |
| A. | 钙 | B. | 铁 | C. | 锌 | D. | 钠 |
| A. | 含有NA个氢原子的氢气在标准状况下的体积约为22.4L | |
| B. | 25℃,1.01×105Pa,64gSO2中含有的原子数为3NA | |
| C. | 在常温常压下,11.2LCl2含有的分子数为0.5NA | |
| D. | 标准状况下,11.2LH2O含有的分子数为0.5NA |
| A. | CaCl2 | B. | NaOH | C. | CH4 | D. | CO2 |
 ,CH3CH2OH$→_{△}^{浓硫酸}$CH2=CH2+H2O
,CH3CH2OH$→_{△}^{浓硫酸}$CH2=CH2+H2O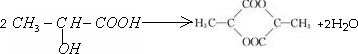 .
. ,F分子保水的原因-COONa 具有亲水性.
,F分子保水的原因-COONa 具有亲水性.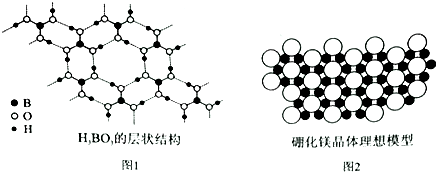 硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、复合材料等高新材料领域.
硼元素在化学中有很重要的地位,硼及其化合物广泛应用于永磁材料、超导材料、复合材料等高新材料领域.