题目内容
11.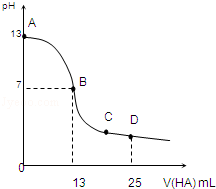 常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:(1)写出MOH的电离方程式:MOH═M++OH-
(2)MOH与HA恰好完全反应时,混合溶液中由水电离出的c(H+)>0.2mol/L HA溶液中由水电离出的c(H+)(填“>”“<”或“=”).
(3)分别写出B、C两点,混合溶液中各离子浓度的大小关系B点c(M+)=c(A-)>c(H+)=c(OH-);C点c(A-)>c(M+)>c(H+)>c(OH-);
(4)若D点测得混合溶液的pH=3,则 c(HA)+c(H+)=0.05mol/L.
分析 (1)由图象可知0.1mol/L MOH溶液的pH=13,c(OH-)=0.1mol/L,说明为强碱,完全电离;
(2)由图象可知,当加入13mL 0.2mol/L HA溶液时,n(HA)=0.0026mol,而n(MOH)=0.0025mol,说明HA过量,但溶液呈中性,说明HA为弱酸,如二者恰好反应,应生成强碱弱酸盐,促进水的电离;
(3)B点溶液呈中性;C点反应已进行完全,HA过量,溶液呈酸性,但MA的物质的量大于HA的物质的量,结合电荷守恒判断;
(4)结合D点溶液的电荷守恒和物料守恒解答.
解答 解:(1)由图象可知0.1mol/L MOH溶液的pH=13,c(OH-)=0.1mol/L,说明为强碱,完全电离,则电离方程式为MOH═M++OH-,
故答案为:MOH═M++OH-;
(2)由图象可知,当加入13mL 0.2mol/L HA溶液时,n(HA)=0.0026mol,而n(MOH)=0.0025mol,说明HA过量,但溶液呈中性,说明HA为弱酸,如二者恰好反应,应生成强碱弱酸盐,水解呈碱性,发生A-+H2O?HA+OH-,促进水的电离,则混合溶液中由水电离出的c(H+)大于0.2mol/L HA溶液中由水电离出的c(H+),
故答案为:>;
(3)B点溶液呈中性,溶液中存在c(M+)=c(A-)>c(H+)=c(OH-),C点反应已进行完全,HA过量,溶液呈酸性,但MA的物质的量大于HA的物质的量,应存在c(A-)>c(M+)>c(H+)>c(OH-),
故答案为:c(M+)=c(A-)>c(H+)=c(OH-);c(A-)>c(M+)>c(H+)>c(OH-);
(4)D点时,加入n(HA)=0.005mol,而加入n(MOH)=0.0025mol,A元素以A-和HA两种形式存在,而M全以M+形式存在,溶液中c(A-)+c(HA)=2c(M+),
c(M+)=0.05mol/L,c(OH-)=1×10-11mol/L,由电荷守恒c(M+)+c(H+)=c(A-)+c(OH-)和物料守恒c(A-)+c(HA)=2c(M+),
求得c(HA)+c(H+)=c(M+)+c(OH-)≈0.05mol/L,
故答案为:0.05mol/L.
点评 本题考查了酸碱混合溶液定性判断,题目难度中等,侧重于学生的分析能力的考查,为高考常见题型,明确图象中各个点的含义是解本题关键,结合电荷守恒、物料守恒来分析解答,注意溶液的导电能力与离子浓度的关系.

| A. | 0.5 mol O3的质量为16 g | B. | 32 g O2中含有的氧分子数为2NA | ||
| C. | 1 g H2中含有电子数为1NA | D. | 3.01×1023个铜原子的质量为64 g |
| A. | 达到平衡时,再充入1molX,该反应的△H变大 | |
| B. | 用Y表示4min内的反应速率为0.1mol/(L•min) | |
| C. | 再向容器中充入1molZ,达到新平衡,n(X):n(Y)=2:1 | |
| D. | 4min后,若升高温度,平衡将向逆反应方向移动,平衡常数K减小 |
已知:CO(g)+H2O(g)?H2(g)+CO2(g)平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(1)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有BCE(选填A、B、C、D、E);
| n(CO) | n(H2O) | n(H2) | n(CO2) | |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
(3)已知在一定温度下,C(s)+CO2(g)?2CO(g)平衡常数K;K的表达式$\frac{{c}^{2}(CO)}{c(C{O}_{2})}$;
C(s)+H2O(g)?CO(g)+H2(g)平衡常数K1;CO(g)+H2O(g)?H2(g)+CO2(g)平衡常数K2;则K、K1、K2之间的关系是:K=$\frac{{K}_{1}}{{K}_{2}}$;
(4)某温度下C(s)+CO2(g)?2CO(g)能判断该反应达到化学平衡状态的依据是CEF;
A.c(CO2)=c(CO) B.K不变 C.容器中的压强不变
D.v正(CO)=2v正(CO2) E.c(CO)保持不变 F.混合气体相对分子质量不变
(5)如图1所示,在甲、乙两容器中都充入1mol C和1mol CO2,并使甲、乙两容器初始容积相等.在相同温度下发生反应C(s)+CO2(g)?2CO(g),并维持反应过程中温度不变.已知甲容器中CO2的转化率随时间变化的图象如图2所示,请在图2中画出乙容器中CO2的转化率随时间变化的图象.

| A. | 10s时,再加入一定量的D,平衡向右移动 | |
| B. | 10s时用D物质表示的速率为0.04mol/(L•S) | |
| C. | 10s时,容器中B的浓度为1.6mol•L-1 | |
| D. | 达到平衡时A的转化率为60%,若要在相同条件下反应达到平衡时A的转化率仍为60%,起始加入n(A)=n(B)即可 |
| A. | 能电离出H+的化合物不一定都是酸 | B. | 2.24LO2的物质的量为0.1mol | ||
| C. | 摩尔是七个基本物理量之一 | D. | CO2的相对分子质量为44g/mol |
| A. | 锌片是正极,铜片上有气泡冒出 | B. | 电流方向是从锌片流向铜片 | ||
| C. | 溶液中硫酸的物质的量不断减小 | D. | 电解液的pH保持不变 |
| A. | 氯乙烷与氢氧化钠醇溶液共热:C2H5Cl+OH-$\stackrel{△}{→}$C2H5OH+Cl- | |
| B. | 溴乙酸与热氢氧化钠溶液反应:BrCH2COOH+OH-=BrCH2COO-+H2O | |
| C. | 苯酚钠溶液中通入少量CO2:2C6H5O-+H2O+CO2→2C6H5OH+CO32- | |
| D. | 乙醛与氢氧化铜碱性悬浊液共热: CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O |