题目内容
19..煤化工中常需研究不同温度下平衡常数、投料比及热值等问题.已知:CO(g)+H2O(g)?H2(g)+CO2(g)平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(1)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有BCE(选填A、B、C、D、E);
| n(CO) | n(H2O) | n(H2) | n(CO2) | |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
(3)已知在一定温度下,C(s)+CO2(g)?2CO(g)平衡常数K;K的表达式$\frac{{c}^{2}(CO)}{c(C{O}_{2})}$;
C(s)+H2O(g)?CO(g)+H2(g)平衡常数K1;CO(g)+H2O(g)?H2(g)+CO2(g)平衡常数K2;则K、K1、K2之间的关系是:K=$\frac{{K}_{1}}{{K}_{2}}$;
(4)某温度下C(s)+CO2(g)?2CO(g)能判断该反应达到化学平衡状态的依据是CEF;
A.c(CO2)=c(CO) B.K不变 C.容器中的压强不变
D.v正(CO)=2v正(CO2) E.c(CO)保持不变 F.混合气体相对分子质量不变
(5)如图1所示,在甲、乙两容器中都充入1mol C和1mol CO2,并使甲、乙两容器初始容积相等.在相同温度下发生反应C(s)+CO2(g)?2CO(g),并维持反应过程中温度不变.已知甲容器中CO2的转化率随时间变化的图象如图2所示,请在图2中画出乙容器中CO2的转化率随时间变化的图象.

分析 (1)C中只有反应物,反应一定向正反应进行建立平衡,800℃时平衡常数K=$\frac{c({H}_{2})×c(C{O}_{2})}{c(CO)×c({H}_{2}O)}$=1,浓度商Qc<K,反应向正反应进行,则n(CO2)•n(H2)<n(CO)•n(H2O);
(2)在1L密闭容器中通入10mol CO和10mol水蒸气,在500℃下经过30s达到平衡,设平衡时消耗的CO为xmol,则:
CO(g)+H2O(g)?H2(g)+CO2(g)
起始量(mol):10 10 0 0
变化量(mol):x x x x
平衡量(mol):10-x 10-x x x
根据平衡常数列方程计算x,再根据v=$\frac{△c}{△t}$计算v(CO)
(3)C(s)+CO2(g)?2CO(g)平衡常数K=$\frac{{c}^{2}(CO)}{c(C{O}_{2})}$;
C(s)+H2O(g)?CO(g)+H2(g)平衡常数K1=$\frac{c(CO)×c({H}_{2})}{c({H}_{2}O)}$,
CO(g)+H2O(g)?H2(g)+CO2(g)平衡常数K2=$\frac{c({H}_{2})×c(C{O}_{2})}{c(CO)×c({H}_{2}O)}$,
(4)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡;
(5)甲、乙两容器中都充入1mol C和1mol CO2,并使甲、乙两容器初始容积相等,甲、乙两容器内起始压强相等,甲容器为恒温恒容,平衡时压强增大,而乙为恒温恒压,故乙中反应速率较慢,到达平衡时间较长,乙中平衡相等为在甲中平衡基础上降低压强,平衡正向移动,故平衡时乙中CO2的转化率.
解答 解:(1)800℃时平衡常数K=$\frac{c({H}_{2})×c(C{O}_{2})}{c(CO)×c({H}_{2}O)}$=1,浓度商Qc<K,反应向正反应进行,则n(CO2)•n(H2)<n(CO)•n(H2O),
A.3×2>1×5,反应向着逆向移动,故A错误;
B.1×1<2×2,反应向着正向移动,故B正确;
C.0×0<3×3,反应向着正向移动,故C正确;
D.2×0.5=1×1,达到平衡状态,故D错误;
E.1×2<1×3,平衡向着正向移动,故E正确;
故答案为:BCE;
(2)在1L密闭容器中通入10mol CO和10mol水蒸气,在500℃下经过30s达到平衡,设平衡时消耗的CO为xmol,则:
CO(g)+H2O(g)?H2(g)+CO2(g)
起始量(mol):10 10 0 0
变化量(mol):x x x x
平衡量(mol):10-x 10-x x x
则$\frac{x×x}{(10-x)×(10-x)}$=9,解得x=7.5,则v(CO)=$\frac{\frac{7.5mol}{1L}}{30s}$=0.25mol•L-1•s-1,
故答案为:0.25mol•L-1•s-1;
(3)C(s)+CO2(g)?2CO(g)平衡常数K=$\frac{{c}^{2}(CO)}{c(C{O}_{2})}$;
C(s)+H2O(g)?CO(g)+H2(g)平衡常数K1=$\frac{c(CO)×c({H}_{2})}{c({H}_{2}O)}$,
CO(g)+H2O(g)?H2(g)+CO2(g)平衡常数K2=$\frac{c({H}_{2})×c(C{O}_{2})}{c(CO)×c({H}_{2}O)}$,
故K=$\frac{{c}^{2}(CO)}{c(C{O}_{2})}$=$\frac{c(CO)×c({H}_{2})}{c({H}_{2}O)}$÷$\frac{c({H}_{2})×c(C{O}_{2})}{c(CO)×c({H}_{2}O)}$=$\frac{{K}_{1}}{{K}_{2}}$,
故答案为:$\frac{{c}^{2}(CO)}{c(C{O}_{2})}$;$\frac{{K}_{1}}{{K}_{2}}$;
(4)A.平衡时CO2、CO的浓度关系与转化率有关,平衡时不一定相等,不能证明反应达到平衡状态,故A错误;
B.平衡常数随温度变化,其他条件变化平衡可以发生移动,K不变不能说明反应达到平衡,故B错误;
C.反应前后气体体积变化,随反应进行压强发生变化,当容器中的压强不变时,说明反应达到平衡,故C正确;
D.v正(CO)=2v正(CO2) 均表示正反应速率,速率之比等于化学方程式系数之比,反应始终按该比例关系进行,故D错误;
E.c(CO)保持不变,说明反应得到平衡,故E正确;
F.随反应进行CO2、CO的物质的量之比减小,平均相对分子质量减小,混合气体相对分子质量不变,说明反应达到平衡,故F正确;
故选:CEF;
(5)甲、乙两容器中都充入1mol C和1mol CO2,并使甲、乙两容器初始容积相等,甲、乙两容器内起始压强相等,甲容器为恒温恒容,平衡时压强增大,而乙为恒温恒压,故乙中反应速率较慢,到达平衡时间较长,乙中平衡相等为在甲中平衡基础上降低压强,平衡正向移动,故平衡时乙中CO2的转化率,则乙中CO2的转化率随时间变化的图象为 ;
;
故答案为: .
.
点评 本题考查化学平衡计算与影响因素、平衡常数及其应用、平衡状态判断等,理解掌握化学平衡常数的用途:1、判断反应进行的程度,2、判断反应的热效应,3、判断反应进行的方向,4、计算转化率等.

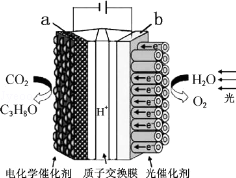 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O),下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O),下列说法正确的是( )| A. | 该装置将化学能转化为光能和电能 | |
| B. | 该装置工作时,H+从a极区向b极区迁移 | |
| C. | 每生成3mol O2,有88gCO2被还原 | |
| D. | a电极的反应为:3CO2+18H+-18e-=C3H8O+5H2O |
| A. | Na2O2中阴、阳离子的个数比为1:1 | |
| B. | Na202比Na2O稳定,保存时可直接露置于空气中 | |
| C. | Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等 | |
| D. | Na2O2分别与水及CO2反应产生相同量的O2时,转移电子的物质的量相等 |
| A. | A和B的平衡浓度之比为5:3 | B. | A和B的平衡浓度之比为2:3 | ||
| C. | x=1 | D. | x:y=2:1 |
(1)写出一种符合下列要求的物质的化学式:
| 分类标准 | 碱性氧化物 | 碱 | 含氧酸 | 盐 |
| 属于该类的物质 | ① | NaOH | ② | ③ |
(2)写出一个无氧酸与碱反应的化学方程式HCl+NaOH=NaCl+H2O
(3)写出一个置换反应的化学方程式CuO+H2=Cu+H2O.
| A. | 铜、石墨均能导电,所以它们均是电解质 | |
| B. | NH3、CO2均是非电解质,所以NH3、CO2的水溶液均不能导电 | |
| C. | 用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 | |
| D. | 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 |

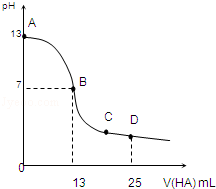 常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题: