题目内容
16.下列说法正确的是( )| A. | 能电离出H+的化合物不一定都是酸 | B. | 2.24LO2的物质的量为0.1mol | ||
| C. | 摩尔是七个基本物理量之一 | D. | CO2的相对分子质量为44g/mol |
分析 A.电离出阳离子全部是氢离子的化合物是酸;
B.气体摩尔体积受温度和压强影响;
C.物质的量的七个基本物理量之一;
D.二氧化碳的相对分子质量单位是“1”.
解答 解:A.电离出阳离子全部是氢离子的化合物是酸,能电离出H+的化合物不一定都是酸,如NaHSO4,故A正确;
B.气体摩尔体积受温度和压强影响,温度和压强未知导致气体摩尔体积未知,所以无法计算其物质的量,故B错误;
C.物质的量的七个基本物理量之一,其单位是mol,故C错误;
D.二氧化碳的相对分子质量单位是“1”,二氧化碳的相对分子质量是44,其摩尔质量是44g/mol,故D错误;
故选A.
点评 本题考查物质的量的有关计算、基本概念,为高频考点,侧重考查学生分析判断能力,注意气体摩尔体积适用范围和适用条件,易错选项是BC.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
13.实验中的下列操作正确的是( )
| A. | 从试剂瓶中取出的一些Na2CO3溶液放入试管中,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | 稀释浓硫酸时,应将浓硫酸倒入水中,边加边搅拌 | |
| C. | 用蒸发方法使NaCl从溶液里析出,应将蒸发皿中NaCl溶液全部蒸干才停止加热 | |
| D. | 分液操作中,分液漏斗中下层液体从下口放出,上层液体也从下口倒出 |
7.在可逆反应2A(g)+3B(g)?xC(g)+yD(g)中,已知起始浓度A为5mol/L,B为3mo1/L,C的反应速率为0.5mol/(L•min),反应开始达到平衡需2min,平衡时D的浓度为0.5mol/L.关于此反应下列说法中正确的是( )
| A. | A和B的平衡浓度之比为5:3 | B. | A和B的平衡浓度之比为2:3 | ||
| C. | x=1 | D. | x:y=2:1 |
1.对于反应A(g)+3B(g)?2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是( )
| A. | v(A)═0.01 mol/(L•s) | B. | v (B)═0.02 mol/(L•s) | ||
| C. | v (B)═0.60mol/(L•min) | D. | v (C)═1.0mol/(L•min) |
8.以H、C、O、Na、Cl、Cu中一种或多种元素组成合适的物质,按下列要求完成各小题
(1)写出一种符合下列要求的物质的化学式:
①CuO或Na2O,②H2CO3或HClO或HClO3,③NaCl或CuCl2或Na2CO3或NaHCO3
(2)写出一个无氧酸与碱反应的化学方程式HCl+NaOH=NaCl+H2O
(3)写出一个置换反应的化学方程式CuO+H2=Cu+H2O.
(1)写出一种符合下列要求的物质的化学式:
| 分类标准 | 碱性氧化物 | 碱 | 含氧酸 | 盐 |
| 属于该类的物质 | ① | NaOH | ② | ③ |
(2)写出一个无氧酸与碱反应的化学方程式HCl+NaOH=NaCl+H2O
(3)写出一个置换反应的化学方程式CuO+H2=Cu+H2O.
5.下列关于胶体的说法正确的是( )
| A. | 胶体的分散质粒子能通过滤纸,而其他分散系的分散质粒子不能通过滤纸 | |
| B. | 氢氧化铁胶体、硫酸铜溶液用激光笔照射,均能观察到一条光亮的通道 | |
| C. | 胶体区分于溶液的本质特征是胶体的分散质粒子直径在1nm~100nm之间 | |
| D. | 氢氧化铝和氢氧化铁胶体可用于净水是因为它们具有强氧化性 |
6.用NA表示阿伏德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2O含有的分子数为1 NA个 | |
| B. | 1mol/L 的MgCl2溶液中,含有Cl-个数为2NA个 | |
| C. | 室温时,1 NA个CO2分子占有的体积为22.4L | |
| D. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02NA个 |
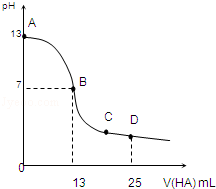 常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题: