题目内容
10.0.1mol/L的下列溶液由常温升高到90℃,溶液的pH不变的是( )| A. | NaCl溶液 | B. | NaOH溶液 | C. | NaHCO3溶液 | D. | NaHSO4溶液 |
分析 弱电解质的电离和盐类水解都是吸热反应,升高温度促进弱电解质电离和盐类水解,导致溶液中水的离子积常数增大,根据溶液中氢离子浓度变化来确定pH变化.
解答 解:A、氯化钠是强电解质,在水溶液里完全电离,升高温度促进水的电离,Kw会升高,氢离子的浓度变大,pH减小,故A错误;
B、升高温度时NaOH溶液中氢氧根离子的浓度不变,但升高温度时水的离子积变大,则氢离子的浓度变大,故溶液的pH变小,故B错误;
C、NaHCO3是强碱弱酸盐,在溶液中能水解显碱性,而升高温度时,水解被促进,故溶液中的氢氧根的浓度增大,故pH会发生变化,故C错误;
D、NaHSO4在溶液中完全电离为钠离子、氢离子和硫酸根,故0.1mol/L的溶液NaHSO4中氢离子浓度为0.1mol/L,当加热时氢离子浓度不变,则pH不变,故D正确.
故选D.
点评 本题考查了pH的简单计算,明确温度对弱电解质的电离、盐类水解的影响是解本题关键,注意A和D选项的比较,升高温度导致水的离子积常数增大,根据溶液中氢离子浓度变化来判断即可,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.I6.根据下列实验操作和现象(或数据),得出的结论正确的是( )
| 操作和现象(或数据) | 结论 | |
| A | 向盛有1 mL 0.1 mol/L MgCl2溶液试管中加1 mL 0.2 mol/L NaOH溶液,有白色沉淀生成,再加入2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 温度相同时,Fe(OH)3溶解度小于Mg(OH)2 |
| B | 向含有少量氢氧化镁沉淀的试管中滴入NH4Cl溶液,沉淀逐渐溶解,并有刺激性的气味气体产生 | 对应的离子反应方程式为NH4++OH-═NH3↑+H2O- |
| C | 20克Ba(OH)2•8H2O粉末和10克NH4Cl粉末混合后玻璃棒迅速搅拌,可以闻到刺激性气味的气体 | 该反应为放热反应,促使氨水分解生成NH3 |
| D | 常温下,将NaAlO2溶液和NaHCO3溶液混合产生大量白色沉淀 | 说明AlO2-结合H+能力大于CO32- |
| A. | A | B. | B | C. | C | D. | D |
1.下列物质属于配合物的是( )
| A. | NH4Cl | B. | Na2CO3•10H2O | C. | Co(NH3)6Cl3 | D. | CuSO4 |
5.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1mol碳正离子(CH3+)所含质子总数为8NA | |
| B. | 常温常压下,46gNO2和N2O4混和气体中含原子总数为3NA | |
| C. | 标准状况下,11.2L氟化氢中含有氟原子的数目为0.5NA | |
| D. | 14g14C原子形成的石墨中,所含C-C健的个数为NA |
15.化合物F是一种医药中间体,其结构简式如图所示,下列有关F的说法正确的是( )
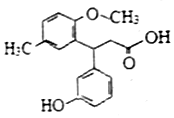

| A. | 所有碳原子可以共平面 | B. | 分子中有1个手性碳原子 | ||
| C. | 能与Na2CO3溶液反应 | D. | 能发生加成、取代、消去反应 |
5.下列说法正确的是( )
| A. | 摩尔是联系宏观和微观的物理量 | |
| B. | Na的摩尔质量为23g/mol | |
| C. | 非标准状况下气体摩尔体积不可能为22.4 L | |
| D. | 1mol氢的质量为2g |
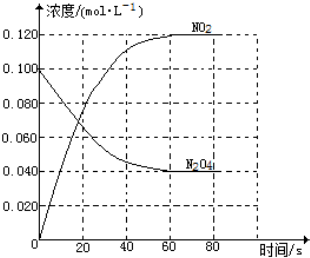 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度的升高,混合气体的颜色变深.
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度的升高,混合气体的颜色变深.