题目内容
18.FeCl3溶液和Fe(OH)3胶体共同具备的性质是( )| A. | 都是红褐色 | B. | 都不能透过半透膜 | ||
| C. | 分散质的粒子都能通过滤纸 | D. | 都能产生丁达尔效应 |
分析 A.氯化铁为黄色,氢氧化铁胶体为红褐色;
B.根据胶体不能通过半透膜,溶液可以通过分析解答;
C.胶体和溶液都可以透过滤纸;
D.只有胶体具有丁达尔效应,溶液不具备;
解答 解:A.因FeCl3溶液与Fe(OH)3胶体的颜色分别为棕黄色、红褐色,故A错误;
B.FeCl3溶液通过半透膜,Fe(OH)3胶体不能通过半透膜,故B错误;
C.Fe(OH)3胶体和FeCl3溶液都能透过滤纸,浊液不能通过滤纸,故C正确.
D.只有胶体具有丁达尔效应,所以Fe(OH)3胶体具有丁达尔效应,而FeCl3溶液不具备,故D错误;
故选C.
点评 本题考查了胶体的性质以及胶体和溶液的区别,题目难度不大,掌握胶体的性质是解题的关键.

练习册系列答案
相关题目
8.关于氡的稳定同位素222Rn,下列说法正确的是( )
| A. | 核内质子数与中子数之差为136 | |
| B. | 氡元素位于元素周期表中第六周期Ⅷ族 | |
| C. | 氡气的分子式为Rn2 | |
| D. | 氡元素性质稳定,很难与其他元素化合 |
9. 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2;元素Y基态原子的3p轨道上有4个电子.X与Y形成的化合物的晶胞如图所示,下列关于该晶体的说法正确的是( )
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2;元素Y基态原子的3p轨道上有4个电子.X与Y形成的化合物的晶胞如图所示,下列关于该晶体的说法正确的是( )
 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2;元素Y基态原子的3p轨道上有4个电子.X与Y形成的化合物的晶胞如图所示,下列关于该晶体的说法正确的是( )
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2;元素Y基态原子的3p轨道上有4个电子.X与Y形成的化合物的晶胞如图所示,下列关于该晶体的说法正确的是( )| A. | 1个晶胞中离子的总数为18 | |
| B. | X2+离子的配位数为8,Y2-离子的配位数为4 | |
| C. | 与每个X2+距离最近的X2+共有12个 | |
| D. | 该化合物的化学式为CaS |
6.设NA为阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 常温下,1L 0.1mol/L HCl溶液中含氢原子数是0.1NA | |
| B. | 标准状况下,2.24L由CO2和O2组成的混合气体中含氧分子数是0.1NA | |
| C. | 10g碳酸钙与足量的稀盐酸充分反应消耗的氢离子数为0.1NA | |
| D. | 标准状况下,11.2L CO和 NO混合气体中与11.2LN2中分子数均为0.5NA |
13.能有效防止铁质栏杆锈蚀的措施是( )
| A. | 接上铜网 | B. | 定期擦去铁锈 | C. | 与石墨相连 | D. | 定期涂上油漆 |
3.在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是( )
| A. | 两种气体的压强相等 | B. | O2和O3的原子个数相等 | ||
| C. | 两种气体的氧化能力相同 | D. | 两种气体的分子数目相等 |
10.氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于区域3的是( )


| A. | 2F2+2H2O═4HF+O2 | B. | AgNO3+NaCl═AgCl↓+NaNO3 | ||
| C. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | D. | MgCl2(熔融)$\frac{\underline{\;高温\;}}{\;}$Mg+Cl2↑ |
7.下列物质中氧原子数目与6.8gH2O2中氧原子数目一定相等的是( )
| A. | 6.72L CO | B. | 6.6gCO2 | C. | 8gSO3 | D. | 9.8gH2SO4 |
8.教材中用酸性KMnO4溶液和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如图乙和表:
(1)用电离方程式表示草酸溶液显酸性的原因H2C2O4?H++HC2O4-、HC2O4-?H++C2O42-
(2)该实验探究的是浓度因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是①<②(填“>”“<”“=”)
(3)若实验①在2min末收集了896mL CO2(标准状况下),则用MnO4-表示该时间内的化学反应速率为v (MnO4-)=0.08mol/(L•min).
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定产生相同体积CO2所需要的时间(或KmnO4溶液完全褪色的时间)来比较化学反应速率.
(5)该实验小组同学发现反应速率如图二所示,其中t1~t2时间内速率变快的主要原因可能是:①该反应放热、②反应放热.
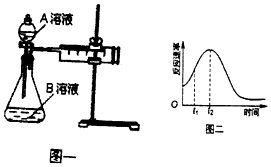
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如图乙和表:
| 实验序号 | A溶液 | B溶液 |
| ① | 20 mL 0.1 mol•L-1H2C2O4溶液 | 30 mL 0.01 mol•L-1kMnO4溶液 |
| ② | 20 mL 0.2 mol•L-1 H2C2O4溶液 | 30 mL 0.01 mol•L-1KMnO4溶液 |
(2)该实验探究的是浓度因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是①<②(填“>”“<”“=”)
(3)若实验①在2min末收集了896mL CO2(标准状况下),则用MnO4-表示该时间内的化学反应速率为v (MnO4-)=0.08mol/(L•min).
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定产生相同体积CO2所需要的时间(或KmnO4溶液完全褪色的时间)来比较化学反应速率.
(5)该实验小组同学发现反应速率如图二所示,其中t1~t2时间内速率变快的主要原因可能是:①该反应放热、②反应放热.
