题目内容
9. 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2;元素Y基态原子的3p轨道上有4个电子.X与Y形成的化合物的晶胞如图所示,下列关于该晶体的说法正确的是( )
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2;元素Y基态原子的3p轨道上有4个电子.X与Y形成的化合物的晶胞如图所示,下列关于该晶体的说法正确的是( )| A. | 1个晶胞中离子的总数为18 | |
| B. | X2+离子的配位数为8,Y2-离子的配位数为4 | |
| C. | 与每个X2+距离最近的X2+共有12个 | |
| D. | 该化合物的化学式为CaS |
分析 元素X位于第四周期,其基态原子的内层轨道全部排满电子,则内层电子数=2+8+18=28,且最外层电子数为2,所以该原子有30个电子,为Zn元素;元素Y基态原子的3p轨道上有4个电子,核外电子排布为1s22s22p63s23p4,则Y是S元素,则化学式为ZnS,据此解答.
解答 解:A.由晶胞可知,1个晶胞中离子的总数为8×$\frac{1}{8}$+6×$\frac{1}{2}$+4=8,故A错误;
B.因为化学式为ZnS,所以Y2-离子的配位数为4,则X2+离子的配位数也为4,故B错误;
C.由晶胞可知,与每个X2+距离最近的X2+在其面心,则共有$\frac{3×8}{2}$=12个,故C正确,
D.根据以上分析,化学式为ZnS,故D错误,
故选:C
点评 本题主要考查了元素的推断以及晶胞的结构及晶胞的计算,难度不大,解题时注重基础知识的运用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.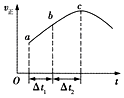 向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到判平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到判平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
 向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到判平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到判平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )| A. | 反应物的总能量低于生成物的总能量 | |
| B. | △t1=△t2时,CO的转化率:a~b段小于b〜c段 | |
| C. | 反应在c点达到平衡状态 | |
| D. | 反应物浓度:a点小于b点 |
20.一定温度、压强下,若一个氦原子实际质量是b g,12C的原子实际质量是a g,氦气的密度为ρ g/cm3,该温度压强下氦气的摩尔体积为Vm L/mol,NA是阿伏加德罗常数的值,下列说法正确的是( )
| A. | 氦原子的相对原子质量是$\frac{12a}{b}$ | B. | 氦气的摩尔质量是(ρVm) g/mol | ||
| C. | m g氦气所含质子数是$\frac{2m}{b}$ | D. | m g氦气的物质的量是$\frac{m}{(b{N}_{A})}$ |
1.下列对对应现象的描述与离子方程式都正确的是( )
| A. | 金属镁与稀盐酸反应:有气体生成,Mg+2 H++2Cl-═MgCl2+H2↑ | |
| B. | 氯化钡溶液与硫酸反应:有白色沉淀生成:SO42-+Ba2+═BaSO4↓ | |
| C. | 碳酸钠溶液与盐酸反应:有气泡逸出:Na2CO3+2 H+═2Na++CO2↑+H2O | |
| D. | 过量铁粉与氯化铜溶液反应:溶液由蓝色变成浅绿色,同时有红色固体生成:Fe+Cu2+═Fe3++Cu |
18.FeCl3溶液和Fe(OH)3胶体共同具备的性质是( )
| A. | 都是红褐色 | B. | 都不能透过半透膜 | ||
| C. | 分散质的粒子都能通过滤纸 | D. | 都能产生丁达尔效应 |