题目内容
(1)火箭残骸中常现红棕色气体,原因为:N2O4(g)?2NO2(g)当温度升高时,气体颜色变深,则反应为 (填“吸热”或“放热”)反应.
(2)一定温度下,上述反应的焓变为△H.现将1mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是 .若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数 (填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)= mol?L-1?s-1.
(2)一定温度下,上述反应的焓变为△H.现将1mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是

考点:反应热和焓变,化学平衡的影响因素
专题:化学反应中的能量变化,化学平衡专题
分析:(1)升高温度,平衡向吸热反应方向移动;
(2)根据达到平衡状态,各组分浓度不变,正逆反应速率相等进行判断;
K=[NO2]2?[N2O2],化学平衡常数只与温度有关,与物质的浓度无关;根据v(NO2)=
计算NO2的化学反应速率,再根据同一反应中、同一时间段内反应速率之比等于计量数之比计算v(N2O4).
(2)根据达到平衡状态,各组分浓度不变,正逆反应速率相等进行判断;
K=[NO2]2?[N2O2],化学平衡常数只与温度有关,与物质的浓度无关;根据v(NO2)=
| △c |
| △t |
解答:
解:(1)升高温度,化学平衡向吸热反应方向移动,当温度升高时,气体颜色变深,平衡向正反应方向移动,所以正反应是吸热反应;
故答案为:吸热;
(2)a、反应方程式两边气体的质量不相等,密度不变,说明达到了平衡状态,故a正确;
b、反应过程中,反应热不会变化,不是变量,无法判断是否达到平衡状态,故b错误;
c、根据反应速率大小,无法判断正逆反应速率是否相等,故c错误;
d、四氧化二氮的转化率不变,说明正逆反应速率相等,达到了平衡状态,故d正确;
K=[NO2]2[N2O2],化学平衡常数只与温度有关,与物质的浓度无关,所以平衡常数K不变,v(NO2)=
=
=0.2mol/L?s,则v(N2O4)=
×v(NO2)=0.1mol/(L?s).
故答案为:ad;不变;0.1.
故答案为:吸热;
(2)a、反应方程式两边气体的质量不相等,密度不变,说明达到了平衡状态,故a正确;
b、反应过程中,反应热不会变化,不是变量,无法判断是否达到平衡状态,故b错误;
c、根据反应速率大小,无法判断正逆反应速率是否相等,故c错误;
d、四氧化二氮的转化率不变,说明正逆反应速率相等,达到了平衡状态,故d正确;
K=[NO2]2[N2O2],化学平衡常数只与温度有关,与物质的浓度无关,所以平衡常数K不变,v(NO2)=
| △c |
| △t |
| ||
| 3s |
| 1 |
| 2 |
故答案为:ad;不变;0.1.
点评:本题考查了氧化剂的判断、化学反应速率的计算等知识点,注意化学平衡常数只与温度有关,与物质的浓度无关.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列反应的离子方程式正确的是( )
| A、醋酸与锌粒反应:2H++Zn=H2↑+Zn2+ | ||||
| B、用FeCl3溶液腐蚀铜板:Cu+Fe3+=Cu2++Fe2+ | ||||
| C、向CaCl2溶液中通入少量CO2气体:Ca2++CO2+H2O=CaCO3↓+2H+ | ||||
D、用石墨电极电解食盐水:2Cl-+2H2O
|
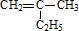 的键线式
的键线式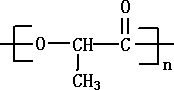 是由一种单体缩聚而成的,该单体的结构简式为
是由一种单体缩聚而成的,该单体的结构简式为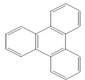 的一氯取代物有
的一氯取代物有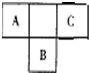 短周期元素的A、B、C在元素周期表中的位置如右图所示,已知A、C 两种元素的原子核外电子数之和等于B的质子数,B原子核内质子数和中子数相等.据此填空:
短周期元素的A、B、C在元素周期表中的位置如右图所示,已知A、C 两种元素的原子核外电子数之和等于B的质子数,B原子核内质子数和中子数相等.据此填空: