题目内容
10.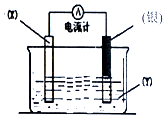 根据氧化还原反应:2Ag++Cu═Cu2++2Ag 设计的原电池如图所示.请回答下列问题:
根据氧化还原反应:2Ag++Cu═Cu2++2Ag 设计的原电池如图所示.请回答下列问题:(1)电极X的材料是Cu(填化学式),电解质溶液Y是AgNO3(填化学式).
(2)银电极为电池的正极,发生的电极反应为Ag++e-=Ag.
(3)外电路中的电子流入(填“流出”或“流入”)银电极.
分析 (1)根据电池反应式知,失电子化合价升高的金属作负极,不如负极活泼的金属或导电的非金属作正极,得电子的化合价降低的可溶性反应物作电解质溶液,据此设计原电池;
(2)原电池中,易失电子的电极铜为负极,银作正极,正极上得电子发生还原反应;
(3)电子从负极沿导线流向正极.
解答 解:(1)由反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”可知,在反应中,Cu被氧化,失电子,应为原电池的负极,所以X电极材料是Cu,Ag+在正极上得电子被还原,电解质溶液为AgNO3 ,
故答案为:Cu;AgNO3;
(2)正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,
故答案为:正; Ag++e-=Ag;
(3)电子从负极Cu沿导线流向正极Ag,故答案为:流入.
点评 本题考查了原电池设计,明确原电池原理是解本题关键,根据电池反应式中得失电子的物质选取负极材料和电解质,知道原电池中正负极的判断方法,题目难度不大.

练习册系列答案
相关题目
2.下列各项中,表述正确的是( )
| A. | 丙烯的分子式为:CH3CH=CH2 | B. | H2O2的电子式为: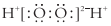 | ||
| C. | S2-的离子结构示意图为: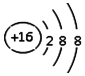 | D. | 苯的比例模型为: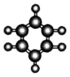 |
1.下列分子间不能形成氢键的是( )
| A. | CH4 | B. | NH3 | C. | H2O | D. | HF |
18.哈伯因发明了由氮气合成氨气的方法而获得1918年诺贝尔化学奖.现向一恒压密闭容器中充入1mol N2和3mol H2,在一定条件下发生反应N2+3H2?2NH3.下列有关说法正确的是( )
| A. | N2完全转化为NH3时,即可视为达到化学平衡状态 | |
| B. | 达到化学平衡时,容器内压强和气体密度都不再变化 | |
| C. | 达到化学平衡时,反应则停止进行 | |
| D. | 达到化学平衡时,3ν(逆NH3)=2ν(正H2) |
5.下列说法正确的是( )
| A. | 为提高燃料的燃烧效率,往往通入大大过量的空气 | |
| B. | 钢铁易生锈被腐蚀,而铝、银等金属不容易被腐蚀,是因为铁的活泼性强 | |
| C. | 氢氧燃料电池把氢气和氧气燃烧放出的热能转化为电能 | |
| D. | 在实验室使用块状而非粉末状碳酸钙与稀盐酸反应制取CO2,是为了控制CO2生成的速率 |
15. 异戊烯醇用于苯氯菊酯杀虫剂以及其他精细化学品的合成,是生产医药或农药的重要原
异戊烯醇用于苯氯菊酯杀虫剂以及其他精细化学品的合成,是生产医药或农药的重要原
料,其结构如图,下列关于异戊烯醇的说法错误的是( )
 异戊烯醇用于苯氯菊酯杀虫剂以及其他精细化学品的合成,是生产医药或农药的重要原
异戊烯醇用于苯氯菊酯杀虫剂以及其他精细化学品的合成,是生产医药或农药的重要原料,其结构如图,下列关于异戊烯醇的说法错误的是( )
| A. | 分子式为C5H10O | |
| B. | 与氢气发生加成反应后生成物名称为2-甲基-丁醇 | |
| C. | 可使酸性KMnO4溶液褪色 | |
| D. | 与 互为同分异构体 互为同分异构体 |
2.下列指定反应的离子方程式正确的是( )
| A. | BaSO3与稀HNO3反应:BaSO3+2H+═Ba2++SO2↑+H2O | |
| B. | Ca(OH)2溶液与过量NaHCO3溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+═I2+3H2O | |
| D. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ |
19.下列方法用于快速、微量、精确测定有机物相对分子质量的是( )
| A. | 元素分析 | B. | 红外光谱 | C. | 质谱 | D. | 核磁共振氢谱 |
20.化学与科学、技术、社会、环境密切相关,下列有关说法中正确的是( )
| A. | 为防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰 | |
| B. | 高温条件能杀死H7N9禽流感病毒,是因为病毒的蛋白质受热变性 | |
| C. | 为消除碘缺乏症,卫生部规定必须在食盐中加单质碘 | |
| D. | 油脂是产生能量很高的营养物质,在饮食中不必控制油脂的摄入量 |