题目内容
15. 异戊烯醇用于苯氯菊酯杀虫剂以及其他精细化学品的合成,是生产医药或农药的重要原
异戊烯醇用于苯氯菊酯杀虫剂以及其他精细化学品的合成,是生产医药或农药的重要原料,其结构如图,下列关于异戊烯醇的说法错误的是( )
| A. | 分子式为C5H10O | |
| B. | 与氢气发生加成反应后生成物名称为2-甲基-丁醇 | |
| C. | 可使酸性KMnO4溶液褪色 | |
| D. | 与 互为同分异构体 互为同分异构体 |
分析 有机物含有碳碳双键,可发生加成、加聚和氧化反应,含有羟基,可发生取代、氧化反应,以此解答该题.
解答 解:A.由结构简式可知有机物分子式为C5H10O,故A正确;
B.含有碳碳双键,可与氢气发生加成反应,产物为3-甲基-1-丁醇,故B错误;
C.含有碳碳双键,可被高锰酸钾氧化,故C正确;
D.与 分子式相同,但结构不同,互为同分异构体,故D正确.
分子式相同,但结构不同,互为同分异构体,故D正确.
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重烯烃、醇性质的考查,题目难度不大.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
6.甲、乙两种非金属,能说明甲比乙的非金属性强的是( )
①甲比乙的单质容易与H2化合 ②甲单质能与乙的简单阴离子发生置换反应 ③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强 ④与某金属反应时,甲原子得电子数目比乙的多 ⑤甲的单质熔、沸点比乙的低.
①甲比乙的单质容易与H2化合 ②甲单质能与乙的简单阴离子发生置换反应 ③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强 ④与某金属反应时,甲原子得电子数目比乙的多 ⑤甲的单质熔、沸点比乙的低.
| A. | 全部 | B. | 只有⑤ | C. | ①②③ | D. | ①②③④ |
3.下列解释事实的离子方程式不正确的是( )
| A. | Na放入水中,产生气体:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | FeCl3溶液滴在淀粉碘化钾试纸上,试纸变蓝:2Fe3++2I-═2Fe2++I2 | |
| C. | 铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| D. | 氯气溶于水:Cl2+H2O?H++Cl-+HClO |
20.下列物质转化在给定条件下能实现的是( )
| A. | FeS2$\stackrel{煅烧}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | NaCl(aq)$\stackrel{电解}{→}$Na$\stackrel{点燃}{→}$Na2O2 | |
| C. | Fe$\stackrel{稀H_{2}SO_{4}}{→}$FeSO4(aq)$\stackrel{NaOH}{→}$Fe(OH)2$\stackrel{空气中的灼烧}{→}$Fe2O3 | |
| D. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{Cu}{→}$Fe |
7.下列实验操作或装置符合实验要求的是( )
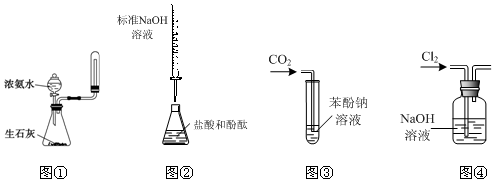

| A. | 实验室利用图①装置制取并收集氨气 | |
| B. | 利用图②装置测定盐酸的浓度 | |
| C. | 利用装置③验证碳酸的酸性强于苯酚 | |
| D. | 利用图④装置除去Cl2中的氯化氢 |
4.常温下,已知KSP(AgCl)=1.8×10-10,含Ag+、H+、NO3-、Cl-的某溶液中,C(Ag+)=0.001mol/L,则该溶液中Cl-的最大浓度为( )mol/L.
| A. | 1.0×10-5 | B. | 0.001mol/L | C. | 1.8×10-7 | D. | 0.1mol/L |
5.下列反应的离子方程式表示正确的是( )
| A. | 用惰性电极电解NaCl溶液2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 铜片跟三氯化铁溶液反应:Fe3++Cu=Cu2++Fe2+ | |
| C. | 用FeSO4除去酸性废水中Cr2O72-:Cr2O72-+6Fe2++7H2O=2Cr3++6Fe3++14OH- | |
| D. | Fe3O4与稀HNO3反应:Fe3O4+8H+=Fe2++2Fe3++4H2O |
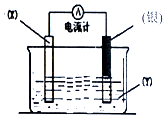 根据氧化还原反应:2Ag++Cu═Cu2++2Ag 设计的原电池如图所示.请回答下列问题:
根据氧化还原反应:2Ag++Cu═Cu2++2Ag 设计的原电池如图所示.请回答下列问题: