题目内容
1.下列分子间不能形成氢键的是( )| A. | CH4 | B. | NH3 | C. | H2O | D. | HF |
分析 氢键结合的通式,可用X-H…Y表示.式中X和Y代表F,O,N等电负性大而原子半径较小的非金属原子.X和Y可以是两种相同的元素,也可以是两种不同的元素.
解答 解:A.甲烷中碳原子的电负性不大,故分子间不能形成氢键,故A选,
B.氨气分子间能形成氢键,表示为:N-H…N,故B不选,
C.H2O分子间能形成氢键,表示为:O-H…O,故C不选;
D.氟化氢分子间能形成氢键,表示为:F-H…F,故D不选;
故选A.
点评 本题考查氢键的形成条件,难度不大.要注意电负性大而原子半径较小的非金属原子与H原子结合才能形成氢键.

练习册系列答案
相关题目
13.某元素R的核内含有N个中子,R的质量数为A,在其与氢化合时,R呈-n价,则WgR的气态氢化物中所含电子的物质的量为( )
| A. | $\frac{A}{W+n}$(N-n)mol | B. | $\frac{W}{A+n}$(N+n)mol | C. | $\frac{W}{A+n}$(A-N+n)mol | D. | $\frac{W}{A+n}$(N-A-n)mol |
14.硅是目前半导体工业中最重要的基础原料,其导电性对哦杂质等十分敏感,因此,必须制备高纯度硅.虽然地壳中硅的含量丰富,但大多数以化合物形式存在,需要通过化学方法来制备高纯度的单晶硅,一种简单工艺流程如下:

(1)石英砂的主要成分是SiO2 (填写化学式),反应器甲中发生反应的化学方程式为SiO2+C$\frac{\underline{\;1600-1800℃\;}}{\;}$Si(粗)+2CO↑.
(2)石英砂与焦炭在一定条件下反应也会生成碳化硅,碳化硅又称金刚砂,其晶体类型为原子晶体.
(3)①反应器乙中发生的反应为:Si(s)+3HCl(g)=SiHCl3(g)+H2(g)△H=-210kJ/mol,工业上为了加快SiHC13的生成速率而又不降低硅的转化率,可以采用的方法是催化剂、增大压强或HCl浓度.
②反应器乙所得的反应产物中,SiHCl3大约占85%,还有SiCl4等,有关物质的沸点数据如一下:
提纯SiHCl3的主要工艺操作依次为沉降、冷凝、精馏,其中精馏温度最好控制在31.8℃.
③SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,其水解的反应方程式为SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑.
(4)反应器丙中发生的反应的化学方程式为H2+SiHCl3$\frac{\underline{\;1100-1200℃\;}}{\;}$Si+3HCl
(5)该生产工艺中可以循环使用的物质是氯化氢、氢气.

(1)石英砂的主要成分是SiO2 (填写化学式),反应器甲中发生反应的化学方程式为SiO2+C$\frac{\underline{\;1600-1800℃\;}}{\;}$Si(粗)+2CO↑.
(2)石英砂与焦炭在一定条件下反应也会生成碳化硅,碳化硅又称金刚砂,其晶体类型为原子晶体.
(3)①反应器乙中发生的反应为:Si(s)+3HCl(g)=SiHCl3(g)+H2(g)△H=-210kJ/mol,工业上为了加快SiHC13的生成速率而又不降低硅的转化率,可以采用的方法是催化剂、增大压强或HCl浓度.
②反应器乙所得的反应产物中,SiHCl3大约占85%,还有SiCl4等,有关物质的沸点数据如一下:
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 |
③SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,其水解的反应方程式为SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑.
(4)反应器丙中发生的反应的化学方程式为H2+SiHCl3$\frac{\underline{\;1100-1200℃\;}}{\;}$Si+3HCl
(5)该生产工艺中可以循环使用的物质是氯化氢、氢气.
9.为了测定实验室长期存放的Na2SO3固体的纯度,准确称取W g固体样品,配成250mL溶液.设计了以下两种实验方案:
方案I:取25.00mL上述溶液→加入足量的盐酸酸化的BaCl2溶液→操作I→洗涤→操作Ⅱ→称量,得到沉淀的质量为m1 g
方案Ⅱ:取25.00mL上述溶液,用a mol/L 的酸性KMnO4溶液进行滴定.(5SO32-+2MnO4-+6H+→5SO42-+2Mn2++3H2O)
实验中所记录的数据如表:
(1)配制250mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、滴管、药匙和电子天平、250mL的容量瓶.
(2)操作I为过滤操作Ⅱ为干燥
(3)方案I中如何判别加入的氯化钡已经过量静置分层后,向上清液中加入盐酸酸化的氯化钡,不再产生沉淀,即已沉淀完全在方案Ⅱ中滴定终点的判断方法是加入最后一滴后溶液由无色变为紫色,且在半分钟内不褪.
(4)根据方案Ⅱ所提供的数据,计算Na2SO3的纯度为$\frac{6300a}{W}$%.(写成分数形式)
有同学模仿方案I,提出方案Ⅲ:取25.00mL上述溶液→加入足量的盐酸酸化的Ba(NO3)2溶液→操作I→洗涤→操作Ⅱ→称重,得到沉淀质量为m2 g 并用方案I的方法计算结果.
(5)根据方案Ⅲ,从理论上讲,下列说法正确的是bd(填序号)
a.方案I比方案Ⅲ的计算结果要低 b.方案I比方案Ⅲ的计算结果要高
c.m1=m2,方案I和方案Ⅲ的结果一样 d.方案Ⅲ不应根据方案I的方法计算
(6)上述实验中,由于操作错误所引起的实验误差分析正确的是ad(填序号).
a.方案I中如果没有洗涤操作,实验结果将偏小
b.方案I中如果没有操作Ⅱ,实验结果将偏大
c.方案Ⅲ中如果没有洗涤操作,实验结果将偏小
d.方案Ⅲ中如果没有操作Ⅱ,实验结果将偏大.
方案I:取25.00mL上述溶液→加入足量的盐酸酸化的BaCl2溶液→操作I→洗涤→操作Ⅱ→称量,得到沉淀的质量为m1 g
方案Ⅱ:取25.00mL上述溶液,用a mol/L 的酸性KMnO4溶液进行滴定.(5SO32-+2MnO4-+6H+→5SO42-+2Mn2++3H2O)
实验中所记录的数据如表:
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| 待测溶液体积/mL | 25.00 | 25.00 | 25.00 | 25.00 |
| 滴定管初读数/mL | 0.00 | 0.20 | 0.10 | 0.15 |
| 滴定管末读数/mL | 20.95 | 21.20 | 20.15 | 21.20 |
(2)操作I为过滤操作Ⅱ为干燥
(3)方案I中如何判别加入的氯化钡已经过量静置分层后,向上清液中加入盐酸酸化的氯化钡,不再产生沉淀,即已沉淀完全在方案Ⅱ中滴定终点的判断方法是加入最后一滴后溶液由无色变为紫色,且在半分钟内不褪.
(4)根据方案Ⅱ所提供的数据,计算Na2SO3的纯度为$\frac{6300a}{W}$%.(写成分数形式)
有同学模仿方案I,提出方案Ⅲ:取25.00mL上述溶液→加入足量的盐酸酸化的Ba(NO3)2溶液→操作I→洗涤→操作Ⅱ→称重,得到沉淀质量为m2 g 并用方案I的方法计算结果.
(5)根据方案Ⅲ,从理论上讲,下列说法正确的是bd(填序号)
a.方案I比方案Ⅲ的计算结果要低 b.方案I比方案Ⅲ的计算结果要高
c.m1=m2,方案I和方案Ⅲ的结果一样 d.方案Ⅲ不应根据方案I的方法计算
(6)上述实验中,由于操作错误所引起的实验误差分析正确的是ad(填序号).
a.方案I中如果没有洗涤操作,实验结果将偏小
b.方案I中如果没有操作Ⅱ,实验结果将偏大
c.方案Ⅲ中如果没有洗涤操作,实验结果将偏小
d.方案Ⅲ中如果没有操作Ⅱ,实验结果将偏大.
16.某有机物的结构如图所示,下列说法正确的是( )
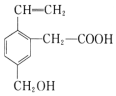

| A. | 有机物的分子式为C11H14O3 | |
| B. | 有机物中含有4种不同的官能团 | |
| C. | 0.5 mol 该有机物与足量NaOH溶液反应,消耗NaOH 1mol | |
| D. | 0.5 mol 该有机物与足量金属钠反应,能生成标准状况下的氢气11.2L |
6.甲、乙两种非金属,能说明甲比乙的非金属性强的是( )
①甲比乙的单质容易与H2化合 ②甲单质能与乙的简单阴离子发生置换反应 ③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强 ④与某金属反应时,甲原子得电子数目比乙的多 ⑤甲的单质熔、沸点比乙的低.
①甲比乙的单质容易与H2化合 ②甲单质能与乙的简单阴离子发生置换反应 ③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强 ④与某金属反应时,甲原子得电子数目比乙的多 ⑤甲的单质熔、沸点比乙的低.
| A. | 全部 | B. | 只有⑤ | C. | ①②③ | D. | ①②③④ |
13.下列叙述错误的是( )
| A. | 共价化合物中只含共价键 | |
| B. | 碳酸氢铵受热分解产生氨气不仅破坏离子键还破坏了共价键 | |
| C. | 干冰变为二氧化碳气体,因共价键被破坏需吸收能量 | |
| D. | 离子化合物中可能含有共价键 |
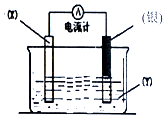 根据氧化还原反应:2Ag++Cu═Cu2++2Ag 设计的原电池如图所示.请回答下列问题:
根据氧化还原反应:2Ag++Cu═Cu2++2Ag 设计的原电池如图所示.请回答下列问题: