题目内容
2.下列指定反应的离子方程式正确的是( )| A. | BaSO3与稀HNO3反应:BaSO3+2H+═Ba2++SO2↑+H2O | |
| B. | Ca(OH)2溶液与过量NaHCO3溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+═I2+3H2O | |
| D. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑ |
分析 A.发生氧化还原反应生成硫酸钡、NO和水;
B.Ca(OH)2完全反应,生成碳酸钙、碳酸钠和水;
C.电子、电荷不守恒;
D.反应生成硫酸钠、氢氧化铜和氢气.
解答 解:A.BaSO3与稀HNO3反应的离子反应为3BaSO3+2NO3-+2H+═3BaSO4↓+2NO↑+H2O,故A错误;
B.Ca(OH)2溶液与过量NaHCO3溶液反应的离子反应为2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32-,故B错误;
C.酸性溶液中KIO3与KI反应生成I2的离子反应为IO3-+5I-+6H+═3I2+3H2O,故C错误;
D.向CuSO4溶液中加入Na2O2的离子反应为2Na2O2+2Cu2++2H2O═4Na++2Cu(OH)2↓+O2↑,故D正确;
故选D.
点评 本题考查离子方程式的书写,为高频考点,把握发生的反应、离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒的判断,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.硅是目前半导体工业中最重要的基础原料,其导电性对哦杂质等十分敏感,因此,必须制备高纯度硅.虽然地壳中硅的含量丰富,但大多数以化合物形式存在,需要通过化学方法来制备高纯度的单晶硅,一种简单工艺流程如下:

(1)石英砂的主要成分是SiO2 (填写化学式),反应器甲中发生反应的化学方程式为SiO2+C$\frac{\underline{\;1600-1800℃\;}}{\;}$Si(粗)+2CO↑.
(2)石英砂与焦炭在一定条件下反应也会生成碳化硅,碳化硅又称金刚砂,其晶体类型为原子晶体.
(3)①反应器乙中发生的反应为:Si(s)+3HCl(g)=SiHCl3(g)+H2(g)△H=-210kJ/mol,工业上为了加快SiHC13的生成速率而又不降低硅的转化率,可以采用的方法是催化剂、增大压强或HCl浓度.
②反应器乙所得的反应产物中,SiHCl3大约占85%,还有SiCl4等,有关物质的沸点数据如一下:
提纯SiHCl3的主要工艺操作依次为沉降、冷凝、精馏,其中精馏温度最好控制在31.8℃.
③SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,其水解的反应方程式为SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑.
(4)反应器丙中发生的反应的化学方程式为H2+SiHCl3$\frac{\underline{\;1100-1200℃\;}}{\;}$Si+3HCl
(5)该生产工艺中可以循环使用的物质是氯化氢、氢气.

(1)石英砂的主要成分是SiO2 (填写化学式),反应器甲中发生反应的化学方程式为SiO2+C$\frac{\underline{\;1600-1800℃\;}}{\;}$Si(粗)+2CO↑.
(2)石英砂与焦炭在一定条件下反应也会生成碳化硅,碳化硅又称金刚砂,其晶体类型为原子晶体.
(3)①反应器乙中发生的反应为:Si(s)+3HCl(g)=SiHCl3(g)+H2(g)△H=-210kJ/mol,工业上为了加快SiHC13的生成速率而又不降低硅的转化率,可以采用的方法是催化剂、增大压强或HCl浓度.
②反应器乙所得的反应产物中,SiHCl3大约占85%,还有SiCl4等,有关物质的沸点数据如一下:
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 |
③SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,其水解的反应方程式为SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑.
(4)反应器丙中发生的反应的化学方程式为H2+SiHCl3$\frac{\underline{\;1100-1200℃\;}}{\;}$Si+3HCl
(5)该生产工艺中可以循环使用的物质是氯化氢、氢气.
13.下列叙述错误的是( )
| A. | 共价化合物中只含共价键 | |
| B. | 碳酸氢铵受热分解产生氨气不仅破坏离子键还破坏了共价键 | |
| C. | 干冰变为二氧化碳气体,因共价键被破坏需吸收能量 | |
| D. | 离子化合物中可能含有共价键 |
17.下列对分子性质的解释中,不正确的是( )
| A. | 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键 | |
| B. | 乳酸有一对手性异构体,因为其分子中含有一个手性碳原子 | |
| C. | 碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”解释 | |
| D. | 酸性:HClO4>HClO,因为HClO4的非羟基氧原子数大于次氯酸的非羟基氧原子数 |
7.下列实验操作或装置符合实验要求的是( )
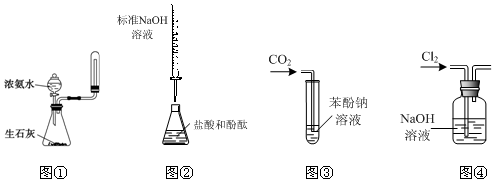

| A. | 实验室利用图①装置制取并收集氨气 | |
| B. | 利用图②装置测定盐酸的浓度 | |
| C. | 利用装置③验证碳酸的酸性强于苯酚 | |
| D. | 利用图④装置除去Cl2中的氯化氢 |
14.700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2<t1):
下列说法正确的是( )
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1min内的平均速率为v(H2)=0.40/t1mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.60 mol CO和0.10 mol H2O,达到平衡时n(CO2)=0.40 mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO和H2O转化率增大 | |
| D. | 温度升高至800℃,达到新平衡时n(CO2)=0.34 mol,则正反应为吸热反应 |
12.下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是( )
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 浓硝酸在光照下颜色变黄 | 浓硝酸具有不稳定性 |
| B | 浓硫酸具有酸性和吸水性 | 浓硫酸可使PH试纸先变红后变黑 |
| C | Cl2和SO2均有漂白性 | Cl2和SO2均可使含有酚酞的NaOH溶液褪色 |
| D | C的还原性小于Si | 可用焦炭和石英在高温下反应制取粗硅和CO2 |
| A. | A | B. | B | C. | C | D. | D |
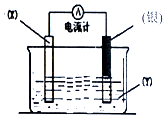 根据氧化还原反应:2Ag++Cu═Cu2++2Ag 设计的原电池如图所示.请回答下列问题:
根据氧化还原反应:2Ag++Cu═Cu2++2Ag 设计的原电池如图所示.请回答下列问题: