题目内容
17.具有还原性的弱酸H3PO2可用电渗析法制备.“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过).下列说法不正确的是( )
| A. | 阳极的电极反应式:4OH--4e-═O2↑+2H2O | |
| B. | 若将阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,同样可制得纯净物的H3PO2 | |
| C. | H3PO2分子中P元素的化合价为+1价 | |
| D. | 阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2 |
分析 由图可知,阴极中阳离子为钠离子和氢离子,氢离子得电子能力强,在阴极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,由于阳极中阴离子为硫酸根离子、氢氧根离子和H2PO2-,其中放电能力最强的是氢氧根离子,则阳极发生的电极反应为4OH-+4e-═O2↑+2H2O;H2PO2-为阴离子,只能通过阴膜即流向产品室;阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2,H2PO2-+H+=H3PO2,若将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是阳极产生的氧气会把H2PO2-或H3PO2氧化成PO43-,产品中混有PO43-,以此来解答.
解答 解:A.阳极上阴离子失去电子,由放电顺序可知,阳极反应为4OH--4e-═O2↑+2H2O,故A正确;
B.阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是阳极产生的氧气会把H2PO2-或H3PO2氧化成PO43-,产品中混有PO43-,不能得到纯净的H3PO2,故B错误;
C.化合物中正负化合价的倒数和为0,则H3PO2分子中P元素的化合价为0-(-2)×2-(+1)×3=+1价,故C正确;
D.H2PO2-为阴离子,只能通过阴膜即流向产品室,而阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2,发生H2PO2-+H+=H3PO2,故D正确;
故选B.
点评 本题考查电解原理,为高频考点,把握离子的移动、放电顺序、电极反应为解答本题关键,侧重分析与应用能力的考查,注意选项B为解答的难点,题目难度不大.

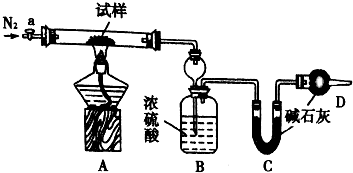 小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3•l0H2O,为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如图装置进行实验.
小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3•l0H2O,为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如图装置进行实验.实验过程:
I.按图组装仪器,检查装置的气密性;
II.将m1 g试样放入硬质玻璃管中,装置B、C、D中药品如图,已知加药品后装置B的质量为m2g、装置C的质量为m3 g;
Ⅲ,关闭活塞a,点燃酒精灯加热试样,直到B装置中无气泡冒出后,打开活塞a向装置中通入N2,一段时间后,撤掉酒精灯,关闭活塞a;Ⅳ.称得装置B的质量为m4g、装置C的质量为m5g.
请回答以下问题(装置中原有空气对实验的影响忽略不计):
(1)装置A中发生反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;Na2CO3•10H2O$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+10H2O.
(2)装置B的作用为吸收反应生成的水蒸气.装置C的作用为吸收反应生成的二氧化碳.
(3)实验过程中通入N2的目的为使装置中的二氧化碳和水蒸气全部排出被装置BC全部吸收.
(4)用下列各项所提供的数据能计算出NaHCO3的质量分数w(NaHCO3)的是bce(填选项字母)
| 序号 | a | b | c | d | e |
| 数据 | m1、m2、m3 | m2、m3、m4、m5 | m1、m2、m4 | m1、m4、m5 | m1、m3、m5 |
| A. | 单晶硅制芯片 | B. | SiO2制光导纤维 | ||
| C. | 金刚砂(碳化硅)作砂轮的磨料 | D. | 水玻璃作黏合剂 |
| 弱酸化学式 | CH3COOH | HCN | H2S |
| 电离常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7K2=7.l×10-15 |
| A. | 等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) | |
| B. | CH3COONa溶液中,其水解平衡常数K=Kw×10-5 | |
| C. | NaHS 和 Na2S混合溶液中,存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) | |
| D. | 某浓度NaCN的水溶液pH=d,则其中c(OH-)=10-d mol•L-1 |
 氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂.
氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂.回答下列问题:
(1)①一氯胺(NH2Cl)的电子式为
 .
.②工业上可利用反应Cl2(g)+NH3(g)═NH2Cl(l)+HCl(g)制备一氯胺,已知部分化学键的键能如下表所示(假设不同物质中同种化学键的链能相同),则该反应的△H=+11.3 kJ/mol.
| 化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
| 键能(kJ/mol) | 391.3 | 243.0 | 191.2 | 431.8 |
(2)用Cl2和NH3反应制备二氯胺的方程式为2Cl2(g)+NH3(g)?NHCl2(l)+2HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2mol C12和2mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
| t/min | 0 | 40 | 80 | 120 | 160 |
| n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(Cl2)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
②该反应的△H< 0(填“>”或“<”),理由是温度越高,反应速率越快,平衡向吸热反应方向移动,其他条件相同时,T℃时的反应速率比400℃时的反应速率快,且乙容器中平衡时Cl2的转化率比甲容器中Cl2的转化率小.
③对该反应,下列说法正确的是AB (填选项字母).
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内C12和NH3物质的量之比不变,则表明反应达到平衡状态
C.反应达到平衡后,其他条件不变,在原容器中充入一定量氦气,Cl2的转化率增大
D.反应达到平衡后,其他条件不变,加入一定量的NHCl2,平衡向逆反应方向移动
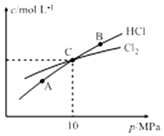
(3)在恒温条件下,2molCl2和1molNH3发生反应2Cl2(g)+NH3(g)?NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:
①A、B、C三点中Cl2转化率最高的是B 点(填“A”“B”或“C”).
②计算C点时该反应的压强平衡常数Kp(C)=0.5MPa(Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数)

| A. | 浓硫酸和铜制SO2 | B. | 用Cu与浓HNO3反应制NO2 | ||
| C. | 用 NH4Cl 与 Ca(OH)2反应制 NH3 | D. | 用锌粒与稀H2SO4反应制H2 |
| A. | 3%H2O2溶液 | B. | 0.1mol•L-1 NaOH 溶液 | ||
| C. | 0.1 mol•L-1 KClO3 溶液 | D. | 0.1 mol•L-1 盐酸 |
