题目内容
1.化合物A是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:A(s)+H2(g)$?_{释氢}^{贮氢}$B(s)+LiH(s)△H=-44.5kJ•mol-1…①
已知:①在液氨中加入金属锂生成B和氢气;
②一定条件下,2.30g固体B与5.35gNH4Cl固体恰好完全反应,生成固体盐C和4.48L气体D(已折算成标准状况);气体D能使湿润的红色石蕊试纸变蓝色.
(1)A的化学式为Li2NH,LiH中r(Li+)小于r(H-)(填“大于”或“小于”).
(2)写出液氨与金属锂反应的化学方程式2Li+2NH3=2LiNH2+H2.
(3)B在加强热时生成NH3和另一种化合物E,该分解反应的化学方程式为3LiNH2$\frac{\underline{\;高温\;}}{\;}$Li3N+2NH3.
(4)化合物E也可以作储氢材料,其储氢原理可表示为:E(s)+H2(g)$?_{释氢}^{贮氢}$A(s)+LiH(s)△H=-165kJ•mol-1…②
储氢材料可以通过加热的方式释放氢气.从实用化角度考虑,选择E(填“A”或“E”)作储氢材料更合理,理由是E的储氢量要比A多.
分析 在一定条件下,2.30g固体B与5.35gNH4Cl固体恰好完全反应,生成固体C和4.48L气体D(标准状况),气体D能使湿润的红色石蕊试纸变蓝色,可推知D为NH3,4.48L氨气的物质的量=$\frac{4.48L}{22.4L/mol}$=0.2mol,其质量=0.2mol×17g/mol=3.4g,根据质量守恒可知B的质量为2.3g+5.35g-3.4g=4.25g,NH4Cl的摩尔质量为53.5g/mol,5.35gNH4Cl为0.1mol,B中含Li,则固体B与NH4Cl固体反应可表为:B+NH4Cl→LiCl+NH3,根据Cl原子守恒,LiCl的物质的量=0.1mol,那么2.3g化合物B中含Li元素也为 0.1mol,再根据质量守恒和原子守恒(原子的种类和数目反应前后相同),则2.3gB中含有N原子为0.2mol-0.1mol=0.1mol,含有H原子为0.2mol×4-0.4mol=0.2mol,可推知B是LiNH2,液氨与金属锂反应生成氢气和LiNH2,
(1)B是LiNH2,根据A(s)+H2(g)$?_{释氢}^{储氢}$B(s)+LiH(s),利用元素守恒可知A的化学式,离子半径大小,Li+,H-,电子层数相同,核电荷数越大半径越小;
(2)B是LiNH2,液氨与金属锂反应生成氢气和LiNH2;
(3)B是LiNH2,根据元素守恒可知,B在加强热时发生分解反应,生成NH3和另一种化合物E为Li3N,据此书写化学方程式;
(4)根据A和E储氢量的多少选择储氢材料.
解答 解:(1)依据分析可知B是LiNH2,根据A(s)+H2(g)$?_{释氢}^{储氢}$B(s)+LiH(s),利用元素守恒可知A的化学式为Li2NH,离子半径大小,Li+,H-,电子层数相同,核电荷数越大半径越小,LiH中r(Li+)小于r(H-),
故答案为:Li2NH;小于;
(2)B是LiNH2,液氨与金属锂反应生成氢气和LiNH2,反应的方程式为2Li+2NH3=2LiNH2+H2,
故答案为:2Li+2NH3=2LiNH2+H2;
(3)推知B是LiNH2,根据元素守恒可知,B在加强热时发生分解反应,生成NH3和另一种化合物E为Li3N,反应的化学方程式为3LiNH2$\frac{\underline{\;高温\;}}{\;}$Li3N+2NH3,
故答案为:3LiNH2$\frac{\underline{\;高温\;}}{\;}$Li3N+2NH3;
(4)根据A的化学式为Li2NH,E为Li3N可知,E的储氢量要比A多,所以选择选择储氢材料E比较合理,
故答案为:E;E的储氢量要比A多.
点评 本题考查无机物推断,侧重考查化学方程式书写,考查了学生对知识的迁移应用与综合分析解决问题能力,把握A中含Li元素,B物质化学式的推断是解题关键,难度较大.

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
| A. | 镁作Y电极 | |
| B. | 电池工作时Na+向负极移动 | |
| C. | 废液的pH大于NaClO溶液的pH | |
| D. | X电极上发生的反应为:ClO-+2H2O-4e-═ClO3-+4H+ |
①臭氧可用于漂白和消毒
②碳酸氢钠可用于治疗胃酸过多
③二氧化硅可用于制作光导纤维
④硅酸钠具有阻燃防火性能.
| A. | 只有①② | B. | 只有②③ | C. | 只有①②③ | D. | 全部正确 |
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)水钴矿进行预处理时加入Na2SO3的主要作用是将Fe3+、Co3+还原.
(2)写出NaClO3在浸出液中发生主要反应的离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,a的取值范围是5.2≤a≤7.6;过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.

A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O的含量,称取16.4g的粗产品溶于水配成100.0mL溶液,从中取出25.0mL与足量AgNO3溶液混合,过滤、洗涤、将沉淀烘干后称其质量为4,.6g,则粗产品中CoCl2•6H2O的质量分数是93%.(结果保留小数点后一位数字)
| A. | 与软脂酸属于同系物的最简单有机物是甲酸 | |
| B. | 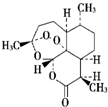 青蒿素是抗疟疾特效药,结构如图所示,有酯基、过氧键和醚键,不溶于水,易溶于氯仿、丙酮等,能够发生水解反应,具有强氧化性 | |
| C. | 油脂在一定条件下水解成高级脂肪酸和甘油,称为皂化反应 | |
| D. | 有X、Y两种有机物,不论何种比例混合,只要其物质的量之和不变,完全燃烧时耗氧气量和生成水的物质的量也不变,若X为CH4,则Y可以是CH3COOH |
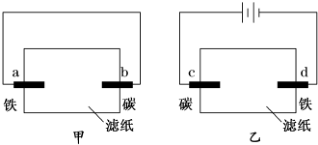
| A. | 滤纸上的阴离子都向碳棒迁移 | B. | a、d两极的电极反应式相同 | ||
| C. | b、d两极附近的溶液都变红 | D. | c、d两极均有少量气体产生 |
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10m) | 0.37 | 1.86 | 1.43 | 0.99 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +1 | +3 | +7 | +5 | - |
| 最低负价 | -1 | - | - | -1 | -3 | -2 | |
| A. | 离子半径:Y>Z>M | |
| B. | Y、Z、M三种元素的最高价氧化物的水化物两两之间会反应 | |
| C. | 化合物XM、YM都是电解质.熔融状态下都能导电 | |
| D. | 元素Z、M、R的离子均能破坏水的电离平衡 |
| A. | 在蒸馏水中滴加稀H2SO4,c(H+)和KW都增大 | |
| B. | 在Na2S稀溶液中,c(OH-)+c(HS-)+2c(S2-)═c(H+)+c(Na+) | |
| C. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | |
| D. | 等体积0.2mol/LHCl溶液与0.05mol/LBa(OH)2溶液混合后,溶液的pH=1 |
| A. | 4 v(NH3)=5 v(O2) | B. | 5 v(O2)=6 v(H2O) | C. | 5 v(NO)=4 v(O2) | D. | 3 v(H2O)=2 v(NH3) |