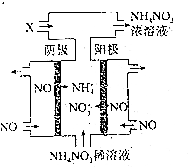
题目内容
12.下列试剂不能把等物质的量浓度的Na2CO3溶液、NaHCO3溶液鉴别开的是( )| A. | CaCl2溶液 | B. | 澄清石灰水 | C. | 稀盐酸 | D. | 酚酞溶液 |
分析 Na2CO3溶液、NaHCO3溶液均与石灰水反应生成白色沉淀,不能鉴别,以此来解答.
解答 解:A.Na2CO3溶液与氯化钙反应生成白色沉淀,NaHCO3溶液与氯化钙不反应,可鉴别,故A不选;
B.二者均与石灰水反应生成白色沉淀,现象相同,不能鉴别,故B选;
C.等浓度时,与盐酸反应生成气体快的为碳酸氢钠,慢的为碳酸钠,可鉴别,故C不选;
D.等浓度时碳酸钠溶液碱性强,则加酚酞红色深的为碳酸钠,可鉴别,故D不选;
故选B.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、性质差异及发生的反应和现象为解答的关键,侧重分析与应用能力的考查,选项C为易错点,题目难度不大.

练习册系列答案
相关题目
19.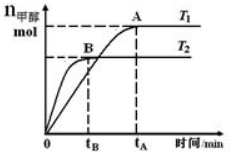 在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示.下列说法正确的是( )
在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示.下列说法正确的是( )
 在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示.下列说法正确的是( )
在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示.下列说法正确的是( )| A. | CO合成甲醇的反应为吸热反应 | |
| B. | 该反应在T1时的平衡常数比T2时的大 | |
| C. | 平衡常数K=$\frac{c(CO)•{c}^{2}({H}_{2})}{c(C{H}_{2}OH)}$ | |
| D. | 处于A点的反应体系从T1变到T2,达到平衡时$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$减小 |
20.在 A+2B?3C+4D 反应中,表示该反应速率最快的是( )
| A. | v(A)=0.3 mol/(L•s) | B. | v(B)=0.5 mol/(L•s) | C. | v(C)=0.8 mol/(L•s) | D. | v(D)=1 mol/(L•min) |
17.在强酸性的溶液中能大量共存的离子组是( )
| A. | Na+、Fe2+、SO32- | B. | Na+、K+、SO42- | C. | K+、SO42-、OH- | D. | Al3+、NO3-、S2- |
17.下列各组溶液,不用外加试剂,就能实现鉴别的是( )
①CuSO4 K2SO4 KNO3 KOH ②Na2CO3 BaCl2 HCl Na2SO4
③NH4NO3 Na2SO4 Ba(OH)2 AlCl3 ④NaAlO2 Na2SiO3 H2SO4 NaCl.
①CuSO4 K2SO4 KNO3 KOH ②Na2CO3 BaCl2 HCl Na2SO4
③NH4NO3 Na2SO4 Ba(OH)2 AlCl3 ④NaAlO2 Na2SiO3 H2SO4 NaCl.
| A. | ①③ | B. | ②④ | C. | ①③④ | D. | ②③④ |
1.相同温度下,体积均为0.50L的两个恒容密闭容器中发生可逆反应:X2(g)+3Y2(g)?2XY3(g)△H=-92.6kJ•mol-1,实验测得反应在起始、达到平衡时的有关数据如下表所示:
下列叙述不正确的是( )
| 容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热23.15 kJ |
| ② | 0.6 | 1.8 | 0.8 | Q(Q>0) |
| A. | 容器①、②中反应的平衡常数相等 | |
| B. | 达平衡时,两个容器中XY3的物质的量浓度均为1mol•l-1 | |
| C. | 容器②中反应达到平衡时放出的热量为Q | |
| D. | 若将容器①体积缩小为0.40 L,则达平衡时放出的热量大于23.15 kJ |
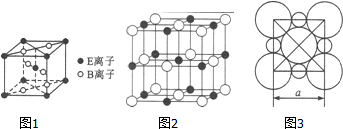 A、B、C、D、E五种常见元素的核电荷数依次增大.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子.请回答下列问题:
A、B、C、D、E五种常见元素的核电荷数依次增大.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子.请回答下列问题: 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: