题目内容
20.居民饮用水的质量必须符合国家标准,如图是源水处理成自来水的工艺流程示意图.看图后回答下列问题.
(1)源水中含Ca2+、Mg2+、HCO${\;}_{3}^{-}$、Cl-等,加入过量石灰后生成Ca(OH)2,进而发生若干复分解反应,例如:HCO3-+OH-═CO32-+H2O 请写出另一个属于复分解反应的离子方程式HCO3-+OH -=CO32-+H2O(或Mg2++2OH-=Mg(OH)2↓或Ca2++HCO3-+OH-=CaCO3↓+H2O).
(2)凝聚剂除去悬浮固体颗粒的过程③
①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4•7H2O是常用的凝聚剂,其在水中电离出的Fe2+离子被溶解在水中的O2所氧化为Fe3+,最终生成胶状沉淀,这种胶状沉淀是Fe(OH)3(写化学式).
(3)配平下列反应方程式,并标出电子转移方向和数目.
Fe2++O2+H+═Fe3++H2O
上述反应中,每转移8mol电子,标准状况下消耗O2的体积为44.8L.
(4)通入二氧化碳的目的是除去Ca2+和调节溶液的酸度.
(5)Cl2的作用是杀菌消毒.
(6)Cl2是常用的强氧化剂,请你尝试写出一个合理的Cl2作为氧化剂的化学方程式.2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl、2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3.
分析 (1)氢氧化钙中的氢氧根离子可以和镁离子,碳酸氢根离子反应;
(2)混凝剂能使固体颗粒沉淀,且混凝剂中的硫酸根离子与钙离子结合生成沉淀,亚铁离子与碱反应生成沉淀易被氧化为氢氧化铁;
(3)根据反应中化合价升降结合电子守恒来配平方程式,根据方程式进行相应的计算;
(4)通入二氧化碳,增大溶液中碳酸根离子浓度并调节酸碱性;
(5)氯气与水反应生成盐酸和次氯酸,HClO具有强氧化性,能杀菌消毒;
(6)氯气具有强氧化性,能和还原性的物质反应.
解答 解:(1)氢氧化钙中的氢氧根离子可以和镁离子,碳酸氢根离子反应,碳酸根离子还可以和钙离子反应,即HCO3-+OH -=CO32-+H2O;Mg2++2OH-=Mg(OH)2↓Ca2++HCO3-+OH-=CaCO3↓+H2O,故答案为:HCO3-+OH -=CO32-+H2O(或Mg2++2OH-=Mg(OH)2↓或Ca2++HCO3-+OH-=CaCO3↓+H2O);
(2)混凝剂能使固体颗粒沉淀,且混凝剂中的硫酸根离子与钙离子结合生成沉淀,亚铁离子与碱反应生成沉淀,则既发生物理变化又发生化学变化,且亚铁离子与碱反应生成沉淀易被氧化为红褐色沉淀Fe(OH)3,故答案为:③;Fe(OH)3;
(3)反应Fe2++O2+H+-Fe3++H2O中Fe的化合价升高了1价,O元素的化合价降低了4价,根据电子守恒,所以Fe元素前边的系数是4,根据电荷守恒,氢离子前边的系数是4,根据元素守恒,水的前边系数是2,即4Fe2++O2+4H+═4Fe3++2H2O,电子转移如下: ,上述反应中,每转移4mol电子,标准状况下消耗O2的物质的量是1mol,所以每转移8mol电子,标准状况下消耗O2的物质的量是2mol,体积为44.8L,
,上述反应中,每转移4mol电子,标准状况下消耗O2的物质的量是1mol,所以每转移8mol电子,标准状况下消耗O2的物质的量是2mol,体积为44.8L,
故答案为: ;44.8;
;44.8;
(4)通入二氧化碳,增大溶液中碳酸根离子浓度,则与钙离子反应生成沉淀,从而除去钙离子,并降低溶液的碱性,调节溶液的酸碱度,
故答案为:除去Ca2+;调节溶液的酸度;
(5)氯气与水反应生成盐酸和次氯酸,该反应为Cl2+H2O═HCl+HClO,HClO具有强氧化性,能杀菌消毒,故答案为:杀菌消毒;
(6)氯气具有强氧化性,可以和金属以及其他具有还原性的离子之间反应,如:2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl、2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,故答案为:2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl、2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3.
点评 本题考查自来水的净化及离子之间的反应,明确净化原理及各物质的性质、发生的化学反应是解答本题的关键,注意氧化还原反应中规律的应用是难点.

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案| A. | 反应能否自发进行与温度无关 | |
| B. | 能自发进行的化学反应,一定是△H>0、△S>0 | |
| C. | 放热反应一定都是自发的 | |
| D. | 电解池的反应不属于自发过程 |
| A. | 淀粉水解 | B. | 酒精挥发 | C. | 水结成冰 | D. | 碘的升华 |
| A. | ②⑤⑥ | B. | ①④⑤ | C. | ①④⑦ | D. | ①④⑤⑦ |
| A. | 恒温恒容:操作1:加1mol N2+3mol H2,操作2:加2mol NH3 | |
| B. | 恒温恒压:操作1:加1mol N2+3mol H2,操作2:加2mol NH3 | |
| C. | 恒温恒容:操作1:加1mol N2+3mol H2,操作2:加3mol NH3 | |
| D. | 恒温恒压:操作1:加1mol N2+3mol H2,操作2:加3mol NH3 |
| A. | 加入盐酸以除去硫酸钠中的少量碳酸钠杂质 | |
| B. | 蒸发时,加热到蒸发皿中出现较多量固体时停止加热 | |
| C. | 用分液漏斗分离液体时,先放出下层液体后,再放出上层液体 | |
| D. | 过滤时,用玻璃棒搅拌漏斗内的混合液以加快过滤速度 |
| A. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g硫化亚铁时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| B. | 稀醋酸与0.1 mol•L-1 NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则可知C的燃烧热△H=-110.5 kJ•mol-1 |
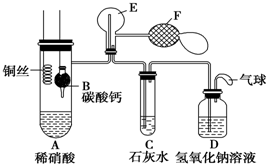 Ⅰ.乙组同学用如图装置来证明铜与稀硝酸反应产生一氧化氮,B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.
Ⅰ.乙组同学用如图装置来证明铜与稀硝酸反应产生一氧化氮,B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.