题目内容
15.在25℃时,0.05mol/L Ba(OH)2溶液的PH=13,c(OH-)水=10-13mol/L.分析 0.05mol/L的Ba(OH)2溶液中c(OH-)=2c(Ba(OH)2)=0.05mol/L×2=0.1mol/L,根据pH=-lgc(H+),结合c(H+)=$\frac{Kw}{c(O{H}^{-})}$计算溶液的pH.
解答 解:0.05mol/L的Ba(OH)2溶液中c(OH-)=2c(Ba(OH)2)=0.05mol/L×2=0.1mol/L,c(OH-)水=c(H+)=$\frac{Kw}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{0.1}$mol/L=10-13mol/L,根据pH=-lgc(H+)=13,故答案为:13;10-13mol/L.
点评 本题考查了pH的简单计算,明确氢氧化钡与氢氧根离子浓度的关系是解本题的关键,难度不大.

练习册系列答案
相关题目
6.氢氰酸(HCN)的下列性质中,不能证明它是弱电解质的是( )
| A. | HCN溶液的导电性比盐酸的弱 | B. | 1mol/LNaCN溶液呈碱性 | ||
| C. | NaCN可以与盐酸反应 | D. | 1mol/LHCN溶液的pH约为3 |
9.已知反应:
①101kPa时,2C(s)+O2(g)═2CO(g);△H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)═H2O;△H=-57.3kJ/mol
下列结论正确的是( )
①101kPa时,2C(s)+O2(g)═2CO(g);△H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)═H2O;△H=-57.3kJ/mol
下列结论正确的是( )
| A. | 碳的燃烧热大于-110.5 kJ/mol | |
| B. | ①的反应热为-221 kJ/mol | |
| C. | 稀硫酸与稀NaOH溶液反应的中和热为-114.6 kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3 kJ热量 |
 用下列装置制取并收集纯净的氯气,试回答下列问题:
用下列装置制取并收集纯净的氯气,试回答下列问题:
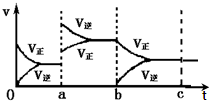 如图表示在密闭容器中反应:2SO2+O2?2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是升温;bc过程与ab过程相比化学平衡常数不变.(填“增大”“减小”或“不变”)
如图表示在密闭容器中反应:2SO2+O2?2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是升温;bc过程与ab过程相比化学平衡常数不变.(填“增大”“减小”或“不变”) 元素X、Y、Z、M、N为短周期主族元素,且原子序数依次增大,已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4且M原子的质子数是Y原子的2倍,N-、Z+、X+的半径逐渐减小,化合物XN在常温下为气体,据此回答下列问题:
元素X、Y、Z、M、N为短周期主族元素,且原子序数依次增大,已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4且M原子的质子数是Y原子的2倍,N-、Z+、X+的半径逐渐减小,化合物XN在常温下为气体,据此回答下列问题: .
.