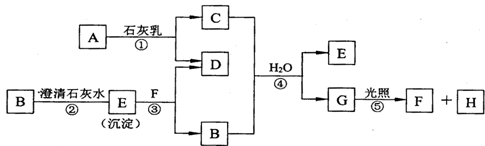
题目内容
15.现有M、X、A、E4种元素的单质,能发生以下反应①在水溶液中,M+X2+═M2++X
②A+2H2O(冷)═A(OH)2+H2↑
③X、E相连浸入稀H2SO4中,电极反应为:X-2e-═X2+,2H++2e-═H2↑
判断它们的还原性由强到弱的顺序是( )
| A. | M、X、A、E | B. | A、M、X、E | C. | M、X、E、A | D. | E、A、M |
分析 依据氧化还原反应的强弱规律,结合题干中反应分析判断,标注化合价判断氧化剂、还原剂、氧化产物、还原产物,依据氧化还原反应中还原剂的还原性大于还原产物,氧化剂的氧化性大于氧化产物,进行判断.
解答 解:①水溶液中,M+X2+═M2++X,还原剂M的还原性大于还原产物X,即M>X;
②A+2H2O(冷)═A(OH)2+H2↑,还原剂A的还原性大于还原产物H2,即A>H2;
③X、E相连浸入稀H2SO4中,电极反应:X-2e-═X2+,2H++2e-═H2↑,说明X易失去电子,还原性X>E;
由于A能和冷水反应,而M在溶液中不与水反应,所以A的还原性最大;
所以还原性由强到弱的顺序是A>M>X>E;故选B.
点评 本题考查了氧化还原反应的概念应用和氧化还原反应的强弱规律应用,主要是还原性强弱的比较判断.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.某化学兴趣小组用如图装置进行“市售锌粒和硫酸反应制取氢气的条件选择”的探究:当B中的化学反应趋于平稳后,每间隔一分钟收集一次氢气.不同条件下,每分钟收集到氢气的体积如表:
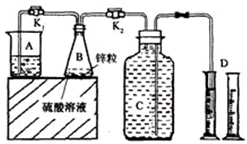
请回答:
(1)关闭K2、打开K1,观察到A中冒出均匀的气泡,说明B反应达到平稳.
(2)实验l、2是对比探究实验,分析上表,说明该对比探究实验的目的是滴加0.5ml的饱和硫酸铜溶液对生成氢气速率的影响.
(3)细口瓶C的容积为V(mL),为了使加入的锌(质量bg)不浪费,在C中还留有$\frac{2}{5}$的水时,则V=$\frac{b{V}_{m}}{39}$[与b的代数关系式,气体摩尔体积是Vm(mL•mol-1)].
(4)实验4是研究饱和硫酸铜溶液的体积对实验的影响,a值应为B(填选项).
A.20 B.30C.27 D.40
(5)分析上表,市售锌粒和硫酸反应制取氢气的条件应该选择实验3(填实验序号).
(6)查资料得知:Cu++Cl-═CuCl↓.
湿法冶锌工艺中,硫酸锌溶液中常含有少量的氯离子,往其中加硫酸铜溶液和金属锌,可除去氯离子,其离子反应方程式是Zn+2Cu2++2Cl-﹦2CuCl↓+Zn2+.

| 实验序号 | 硫酸浓度 | 饱和硫酸铜溶液体积/mL | B反应达到平稳时间/min | 第1分钟收集氢气体积/mL | 第2分钟收集氢气体积/mL | 第3分钟收集氢气体积/mL | … |
| 1 | 20% | 0 | 5.4 | 6.1 | 11.9 | 13.7 | … |
| 2 | 20% | 0.5 | 2.5 | 23.9 | 32.1 | 33.5 | … |
| 3 | 30% | 0.5 | 1.1 | 60.7 | 89.9 | 90.1 | … |
| 4 | a% | 3.0 | 0.8 | 55.7 | 66.0 | 61.4 | … |
(1)关闭K2、打开K1,观察到A中冒出均匀的气泡,说明B反应达到平稳.
(2)实验l、2是对比探究实验,分析上表,说明该对比探究实验的目的是滴加0.5ml的饱和硫酸铜溶液对生成氢气速率的影响.
(3)细口瓶C的容积为V(mL),为了使加入的锌(质量bg)不浪费,在C中还留有$\frac{2}{5}$的水时,则V=$\frac{b{V}_{m}}{39}$[与b的代数关系式,气体摩尔体积是Vm(mL•mol-1)].
(4)实验4是研究饱和硫酸铜溶液的体积对实验的影响,a值应为B(填选项).
A.20 B.30C.27 D.40
(5)分析上表,市售锌粒和硫酸反应制取氢气的条件应该选择实验3(填实验序号).
(6)查资料得知:Cu++Cl-═CuCl↓.
湿法冶锌工艺中,硫酸锌溶液中常含有少量的氯离子,往其中加硫酸铜溶液和金属锌,可除去氯离子,其离子反应方程式是Zn+2Cu2++2Cl-﹦2CuCl↓+Zn2+.
3.我国科学家报道了如图所示的水溶液锂离子二次电池.下列叙述正确的是( )

| A. | a为电池的负极 | |
| B. | 电池充电时a极反应为:Li1-xMn2O4+xe-+xLi+═LiMn2O4 | |
| C. | 充电时,a极锂的化合价发生变化 | |
| D. | 放电时,溶液中SO42-从a向b迁移 |
10.下列有关电解质溶液的说法正确的是( )
| A. | 在蒸馏水中滴加浓硫酸,KW不变 | |
| B. | 在硫化钠稀溶液中,c(H+)═c(OH-)-2c(H2S)-c(HS-) | |
| C. | 氯化钠溶液和醋酸铵溶液均显中性,但两溶液中水的电离程度不相同 | |
| D. | pH=1的强酸溶液加水稀释后,溶液中各离子浓度均减小 |
20.下列各组分子中,都属于含极性键的非极性分子的是( )
| A. | P4 H2S | B. | BF3 CH4 | C. | PH3 SO2 | D. | NH3 HCl |
7.下列叙述中正确的是( )
| A. | 标准状况下,1 mol任何物质的体积都约为22.4 L | |
| B. | 标准状况下,18g H2O所占的体积约为22.4 L | |
| C. | 标准状况下,1mol O2和N2的混合气体的体积约为是22.4L | |
| D. | 在同温同压下,相同体积的任何气体单质所含原子数目相同 |
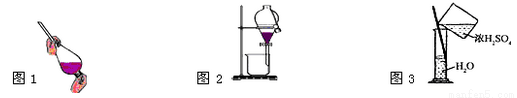
 蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体.根据你所学的知识回答下列问题:
蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体.根据你所学的知识回答下列问题: