题目内容
7.对下列物质进行灼烧,能够得到黑色生成物的是( )| A. | 镁粉 | B. | 铁粉 | C. | 小苏打 | D. | 无水硫酸铜 |
分析 A、镁燃烧生成白粉末氧化镁;
B、铁生成黑色晶体四氧化三铁;
C、小苏打灼烧生成白色粉末碳酸钠;
D、无水硫酸铜生成白色的硫酸铜.
解答 解:A、镁燃烧生成白粉末氧化镁,而不是黑色的,故A错误;
B、铁生成黑色晶体四氧化三铁,符合条件,故B正确;
C、小苏打灼烧生成白色粉末碳酸钠,而不是黑色的,不符合,故C错误;
D、无水硫酸铜生成白色的硫酸铜,而不是黑色的,不符合,故D错误;
故选B.
点评 本题考查元素化合物知识,学生要熟记元素化合的性质是解题的关键,比较容易.

练习册系列答案
相关题目
17.用NaOH固体配制0.1mol/L的NaOH溶液,下列操作或说法正确的是( )
| A. | 定容时俯视刻度线,会使所配溶液浓度偏大 | |
| B. | 将4.0gNaOH固体溶于1L水中可配成0.1mol/L的NaOH溶液 | |
| C. | 固体溶解后,将溶液转移到容量瓶中,然后向容量瓶中直接加水到刻度线 | |
| D. | 称量时,将固体NaOH放在垫有纸的托盘天平左盘上 |
18.某兴趣小组设计了如图所示装置(部分夹持装置已略去)进行实验探究.
【实验一】探究影响化学反应速率的因素.
圆底烧瓶中装锌片(两次实验中所用锌片大小和外形相同)、恒压分液漏斗中装稀硫酸,以生成20.0mL气体为计时终点,结果为t1>t2.
检查该装置气密性的方法是从量气管右侧管口加水至左右两管出现液面高度差时停止加水,若较长时间能保持液面高度差不变,则说明装置气密性好.
比较实验I和Ⅱ可以得出的结论是在其它条件一定时,化学反应速率随反应物浓度的增大而增大.
【实验二】探究铁的电化学腐蚀.

①圆底烧瓶中装铁粉和碳粉混合物,恒压分液漏斗中装稀硫酸,打开活塞加入稀硫酸后量气管中出现的现象是:左侧液面下降右侧液面上升(选填“上升”、“下降”).
②圆底烧瓶中装与①相同量的铁粉和碳粉混合物,恒压分液漏斗中装食盐水,打开活塞加入食盐水后,你预测量气管中出现的现象是:吸氧腐蚀消耗氧气,反应放热使气体温度升高,容器内压强恰好不变,液面没有升降.实际观察到的现象可能与预测并不一致,装置气密性良好,原因是发生吸氧腐蚀消耗氧气,气体分子数减小.
【实验一】探究影响化学反应速率的因素.
圆底烧瓶中装锌片(两次实验中所用锌片大小和外形相同)、恒压分液漏斗中装稀硫酸,以生成20.0mL气体为计时终点,结果为t1>t2.
| 序号 | V(H2SO4)/mL | c(H2SO4)/mol•L-1 | t/s |
| I | 40 | 1 | t1 |
| II | 40 | 3 | t2 |
比较实验I和Ⅱ可以得出的结论是在其它条件一定时,化学反应速率随反应物浓度的增大而增大.
【实验二】探究铁的电化学腐蚀.

①圆底烧瓶中装铁粉和碳粉混合物,恒压分液漏斗中装稀硫酸,打开活塞加入稀硫酸后量气管中出现的现象是:左侧液面下降右侧液面上升(选填“上升”、“下降”).
②圆底烧瓶中装与①相同量的铁粉和碳粉混合物,恒压分液漏斗中装食盐水,打开活塞加入食盐水后,你预测量气管中出现的现象是:吸氧腐蚀消耗氧气,反应放热使气体温度升高,容器内压强恰好不变,液面没有升降.实际观察到的现象可能与预测并不一致,装置气密性良好,原因是发生吸氧腐蚀消耗氧气,气体分子数减小.
15.下列离子反应书写不正确的是( )
| A. | CuSO4溶液与过量浓氨水反应的离子方程式:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+ | |
| B. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| D. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
12.下图是应用电化学方法检测空气中SO2的原理示意图,下列有关说法不正确的是( )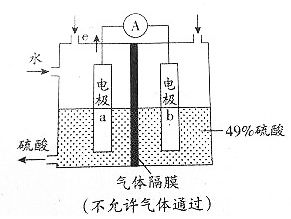

| A. | 该装置工作时能将化学能转化为电能,并有H2SO4生成 | |
| B. | 电极b表面O2发生还原反应,电极b附近溶液的pH升高 | |
| C. | 气体样品从电极a区域通入,样品中的SO2在电极a表面得到电子 | |
| D. | 电极a表面发生的电极反应时为SO2+2H2O-2e-=${SO}_{4}^{2-}$+4H+ |
19.窒温下,0.1mol/L的CH3COOH溶液pH=3,下列判断不正确的是( )
| A. | 向该溶液中加入pH=3的盐酸溶液,溶液的pH值减小 | |
| B. | 向该溶液中加入蒸馏水,CH3COOH和水的电离程度均增加 | |
| C. | CH3COOH(aq)?CH3COO-(aq)+H+(aq),Ka=1.0×10-5 | |
| D. | 0.1mol/L的CH3COONa溶液,溶液的pH=9 |
9.用NA代表阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.3NA | |
| B. | 1L0.1mol•L-1NH4Cl溶液中含有的氮原子数小于0.1NA | |
| C. | 用铅蓄电池电解氯化钠溶液,得到标准状况下22.4L氢气时,理论上铅蓄电池中消耗氢离子数目为4NA | |
| D. | 氢气与氯气反应生成标准状况下22.4L氯化氢,断裂化学键的总数为2NA |
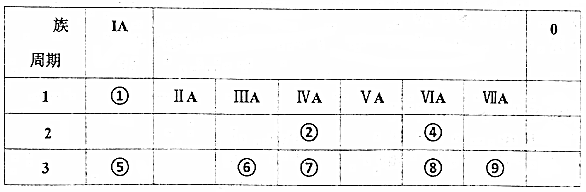
 ;写出元素⑤和⑧形成原子个数比2:1化合物的形成过程:
;写出元素⑤和⑧形成原子个数比2:1化合物的形成过程: .
.