题目内容
15.下列离子反应书写不正确的是( )| A. | CuSO4溶液与过量浓氨水反应的离子方程式:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+ | |
| B. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| D. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
分析 A.反应生成铜氨络离子;
B.反应生成氢氧化铝和硫酸铵;
C.发生氧化还原反应生成铁离子、水;
D.反应生成偏铝酸钠和氢气.
解答 解:A.CuSO4溶液与过量浓氨水反应的离子方程式为Cu2++4NH3•H2O=[Cu(NH3)4]2++4H2O,故A错误;
B.反应生成氢氧化铝和硫酸铵,离子反应为Al3++3NH3•H2O═Al(OH)3↓+3NH4+,与氨水量无关,故B正确;
C.Fe2+与H2O2在酸性溶液中的离子反应为2Fe2++H2O2+2H+═2Fe3++2H2O,遵循电子、电荷守恒,故C正确;
D.Al片溶于NaOH溶液中,产生气体的离子反应为2Al+2OH-+2H2O═2AlO2-+3H2↑,遵循电子、电荷守恒,故D正确;
故选A.
点评 本题考查离子方程式的书写,为高频考点,把握发生的反应、离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应电子、电荷守恒的判断,选项A为解答的难点,题目难度不大.

练习册系列答案
相关题目
6.化学与生产、生活、社会密切相关,下列有关说法中正确的是( )
| A. | 网络飞速发展,得益于光纤良好的导电性,光纤的主要成分是高纯度的二氧化硅 | |
| B. | 古有“靑蒿一握,以水二升漬,绞取汁”,今用乙醚从黄花蒿中提取靑蒿素是利用氧化还原反应原理 | |
| C. | 用K2FeO4代替Cl2处理饮用水,既有杀菌消毒作用,又有净水作用 | |
| D. | 纤维素作为营养物质,在人体内不断分解,最终生成水和二氧化碳排出体外 |
3.在元素周期表中,原子最外电子层只有2个电子的元素是( )
| A. | 无法判断是哪一类元素 | B. | 一定是稀有气体元素 | ||
| C. | 一定是过渡元素 | D. | 一定是金属元素 |
10.下列离子与氖原子核外电子排布不相同的是( )
| A. | Na+ | B. | F- | C. | Al3+ | D. | S2- |
20.下列化学用语表达正确的是( )
| A. | 质量数之和是质子数之和两倍的水分子符号可能是D${\;}_{2}^{16}$O | |
| B. | Mg的原子结构示意图为 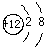 | |
| C. | 次氯酸的电子式为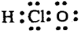 | |
| D. | 少量氢氧化钙溶液与碳酸氢钠溶液混合:OH-+HCO3一═H2O+CO32- |
7.对下列物质进行灼烧,能够得到黑色生成物的是( )
| A. | 镁粉 | B. | 铁粉 | C. | 小苏打 | D. | 无水硫酸铜 |
4.氨与酸反应生成铵盐的实质是( )
| A. | 氨极易溶于水 | B. | 氨具有碱性 | ||
| C. | 氨分子是共价化合物分子 | D. | 氨分子结合H+形成NH4+ |
17.硬铝合金广泛用于现代社会.下列关于硬铝的说法中,错误的是( )
| A. | 硬铝的密度约为钢材的三分之一,是适合于做飞行器的材料 | |
| B. | 硬铝的强度比铝大得多,铝材比钢材的某些性能要好 | |
| C. | 硬铝的熔点跟铝相比有一定的提高,常被用于炊具 | |
| D. | 硬铝的抗腐蚀性较强,常被用于制门窗框架 |
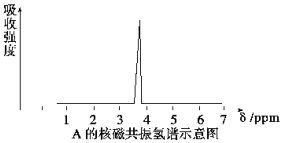 (1)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱如图所示,则A的结构简式为CH2BrCH2Br,请预测B的核磁共振氢谱上有2个峰(信号).
(1)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱如图所示,则A的结构简式为CH2BrCH2Br,请预测B的核磁共振氢谱上有2个峰(信号).