题目内容
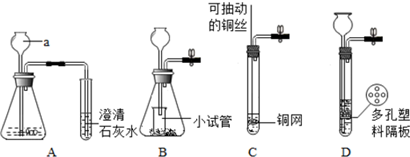
8.下列有关实验的说法正确的是( )| A. | 若用标准盐酸滴定待测 NaOH 溶液,滴定前仰视,滴定后俯视则测定值偏大 | |
| B. | 可用 pH 试纸测定新制氯水的 pH | |
| C. | 中和滴定实验中,洗净后的锥形瓶不需要干燥 | |
| D. | 向白色 ZnS 沉淀上滴加 CuSO4溶液,沉淀变为黑色,说明 Ksp(ZnS)<Ksp(CuS) |
分析 A.滴定前仰视读数,导致标准液读数偏大;滴定后仰视读数,导致标准液读数偏小;
B.次氯酸具有漂白性;
C.中和滴定实验中,洗净后的锥形瓶含有少量水,但不影响溶质的物质的量;
D.溶度积表达式相同时,溶度积大的物质能转化为溶度积小的物质.
解答 解:A.滴定过程中,滴定前仰视读数,导致标准液读数偏大;滴定后仰视读数,导致标准液读数偏小,最终导致消耗的标准液体积偏小,测定结果偏低,故A错误;
B.氯水中含有次氯酸,次氯酸具有漂白性,能漂白pH试纸而导致测定pH值不准确,应该用pH计测定,故B错误;
C.中和滴定实验中,洗净后的锥形瓶含有少量水,但不影响溶质的物质的量,所以不影响测定结果,则不需要干燥锥形瓶,故C正确;
D.溶度积表达式相同时,溶度积大的物质能转化为溶度积小的物质,向白色 ZnS 沉淀上滴加 CuSO4溶液,沉淀变为黑色,说明 Ksp(ZnS)>Ksp(CuS),故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及溶度积大小比较、中和滴定、pH值的测定等知识点,明确实验原理、实验基本操作规范性、物质性质是解本题关键,注意滴定管和量筒中液体读数产生误差的区别,题目难度不大.

练习册系列答案
相关题目
9.下列说法错误的是( )
| A. | 分类是研究物质性质的一种重要方法 | |
| B. | 许多化学定律的提出是建立在实验事实和逻辑推理基础上的 | |
| C. | 假说最终都可以变成科学理论 | |
| D. | 化学基本原理的应用是有一定条件的 |
10.常温下,关于浓度相等的氢氧化钠和氨水,下列说法正确的是( )
| A. | NH3•H2O溶液的c(OH-)<NaOH溶液的c(OH-) | |
| B. | c(Na+)=c(NH4+) | |
| C. | 等体积的氢氧化钠和氨水溶液与足量盐酸完全反应,NaOH消耗的盐酸体积多 | |
| D. | 将等体积的氢氧化钠和氨水溶液加水稀释相同倍数,NaOH溶液的pH大 |
16.强酸和强碱的稀溶液反应的中和热可以表示为:H+(aq)+OH-(aq)=H2O ( l )△H=-57.3kJ•mol-1,
已知:CH3COOH (aq)+NaOH (aq)=CH3COONa (aq)+H2O ( l )△H=-Q1 kJ•mol-1,
$\frac{1}{2}$H2SO4(浓)+NaOH (aq)=$\frac{1}{2}$Na2SO4 (aq)+H2O ( l )△H=-Q2 kJ•mol-1,
上述反应均在溶液中进行,则下列关系正确的是( )
已知:CH3COOH (aq)+NaOH (aq)=CH3COONa (aq)+H2O ( l )△H=-Q1 kJ•mol-1,
$\frac{1}{2}$H2SO4(浓)+NaOH (aq)=$\frac{1}{2}$Na2SO4 (aq)+H2O ( l )△H=-Q2 kJ•mol-1,
上述反应均在溶液中进行,则下列关系正确的是( )
| A. | Q2>Q1>57.3 | B. | Q1=57.3<Q2 | C. | Q2>57.3>Q1 | D. | Q2=57.3>Q1 |
3.判断市面上的金首饰是否含有铜,可以取样品与某试剂进行反应,根据现象即可判断,该试剂是( )
| A. | 浓盐酸 | B. | 硝酸 | C. | 王水 | D. | 稀硫酸 |
20.铝灰的回收利用方法很多,现用含有Al2O3、SiO2和少量FeO•xFe2O3的铝灰制备Al2(SO4)3•18H2O,工艺流程如下:
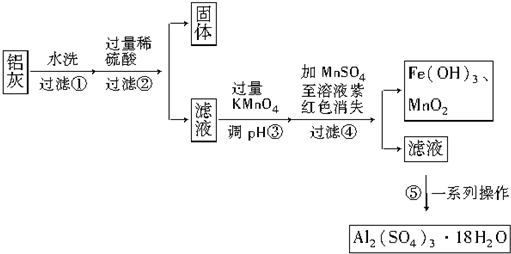
请回答下列问题:
(1)加入过量稀硫酸溶解Al2O3的离子方程式是6H++Al2O3═2Al3++3H2O.
(2)流程中加入的KMnO4也可用H2O2代替,若用H2O2发生反应的化学方程式为H2O2+2FeSO4+H2SO4═Fe2(SO4)3+2H2O.
(3)已知:浓度均为0.1mol•L-1的金属阳离子,生成氢氧化物沉淀的pH如表:
步骤③的目的是将Fe2+氧化为Fe3+,并使Fe3+转化为Fe(OH)3沉淀而除去;
若在该浓度下除去铁的化合物,调节pH的最大范围是2.8≤pH<3.4.
(4)操作④发生反应的离子方程式为3Mn2++2MnO4-+2H2O═5MnO2↓+4H+;为了验证该操作所得固体中确实含有MnO2,可选用的试剂是浓盐酸和双氧水.
(5)操作⑤“一系列操作”,下列仪器中不需用的是B(填序号).
A.蒸发皿 B.坩埚 C.玻璃棒 D.酒精灯 E.漏斗.

请回答下列问题:
(1)加入过量稀硫酸溶解Al2O3的离子方程式是6H++Al2O3═2Al3++3H2O.
(2)流程中加入的KMnO4也可用H2O2代替,若用H2O2发生反应的化学方程式为H2O2+2FeSO4+H2SO4═Fe2(SO4)3+2H2O.
(3)已知:浓度均为0.1mol•L-1的金属阳离子,生成氢氧化物沉淀的pH如表:
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
若在该浓度下除去铁的化合物,调节pH的最大范围是2.8≤pH<3.4.
(4)操作④发生反应的离子方程式为3Mn2++2MnO4-+2H2O═5MnO2↓+4H+;为了验证该操作所得固体中确实含有MnO2,可选用的试剂是浓盐酸和双氧水.
(5)操作⑤“一系列操作”,下列仪器中不需用的是B(填序号).
A.蒸发皿 B.坩埚 C.玻璃棒 D.酒精灯 E.漏斗.
17.下列说法正确的是( )
| A. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色 | |
| B. | 分子式为C4H7ClO2,可与NaHCO3产生CO2的有机物可能结构有3种 | |
| C. | 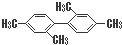 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 | |
| D. | 1mol有机物 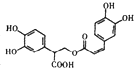 一定条件下能和7molNaOH反应 一定条件下能和7molNaOH反应 |
18.下列说法中正确的是( )
| A. | 红热的铁丝在氯气中燃烧产生棕色的雾 | |
| B. | 含有氯元素的物质都呈黄绿色,均有毒 | |
| C. | 氢气在氯气中燃烧时,火焰显淡蓝色 | |
| D. | 氯水中滴入硝酸银溶液和稀硝酸后,产生白色沉淀 |